 手机访问:wap.265xx.com
手机访问:wap.265xx.com两种单克隆抗体可广泛中和 SARS
美国和加拿大的研究人员描述了两种单克隆抗体的结构基础和作用模式,这些抗体可有效中和严重急性呼吸系统综合症冠状病毒 2 (SARS-CoV-2)——一种导致 2019 年冠状病毒病 (COVID-19) 的病原体。
来自康涅狄格州纽黑文市耶鲁大学医学院的 Walther Mothes 及其同事报告说,这两种抗体——CV3-1 和 CV3-25——在体外和体内均能有效对抗令人担忧的 SARS-CoV-2 变异体。
研究人员说,因此,这些抗体是阐明作用模式和鉴定具有泛冠状病毒活性的表位的主要候选抗体。
他们写道: “我们相信这两种抗体的两个表位对于针对新出现的变异体的被动和主动免疫策略都很有意义。”。
该研究论文的预印本可在 bioRxiv * 服务器上获得,同时该文章接受同行审查。
 研究:针对 SARS-CoV-2 新出现的关注变体的两种广泛中和抗体的结构基础和作用方式。图片来源:NIAID
研究:针对 SARS-CoV-2 新出现的关注变体的两种广泛中和抗体的结构基础和作用方式。图片来源:NIAID
SARS-CoV-2病毒是自2003年以来在人群中出现的第三种贝塔科罗纳病毒,它是2019冠状病毒疾病流行病的罪魁祸首,由于新变种的出现,这种流行病在许多国家仍然得不到控制。
介导感染过程初始阶段的病毒刺突蛋白是自然感染后宿主免疫反应的主要目标。因此,这种刺突免疫原构成了目前在许多国家/地区推出的 Moderna、Pfizer-BioNTech、强生和阿斯利康疫苗的基础。
然而,与 B.1.1.7 (alpha)、B.1.351 (beta)、P.1 (gamma) 和 B.1.617.2 (delta) 菌株相比,与疫苗和感染诱导的免疫相比,它们都表现出更高的传染性和逃逸率。与以前流行的菌株。
尖峰由两个亚基组成。 S1 亚基包含与宿主细胞受体血管紧张素转换酶 2 (ACE2) 相互作用的受体结合域 (RBD),而 S2 包含 S1 脱落后宿主-病毒膜融合所需的机制。
冷冻电子显微镜 (cryoEM) 冷冻电子断层扫描 70 (cryoET) 先前已经揭示了几种不同的预融合构象,其中 RBD 采用“向上”或“向下”配置。 ACE2 受体结合并稳定向上构型的 RBD。
从恢复期或接种疫苗的个体中分离的抗体可以根据它们对三个主要表位的特异性进行分类:RBD、N 端结构域 (NTD) 和 S2 亚基。对于每个抗体类别,已经描述了 RBD-up 或 RBD-down 配置的构象偏好。由于在该域中进化出免疫逃逸突变,针对 RBD 的抗体通常对新出现的关注变体的效力较低。
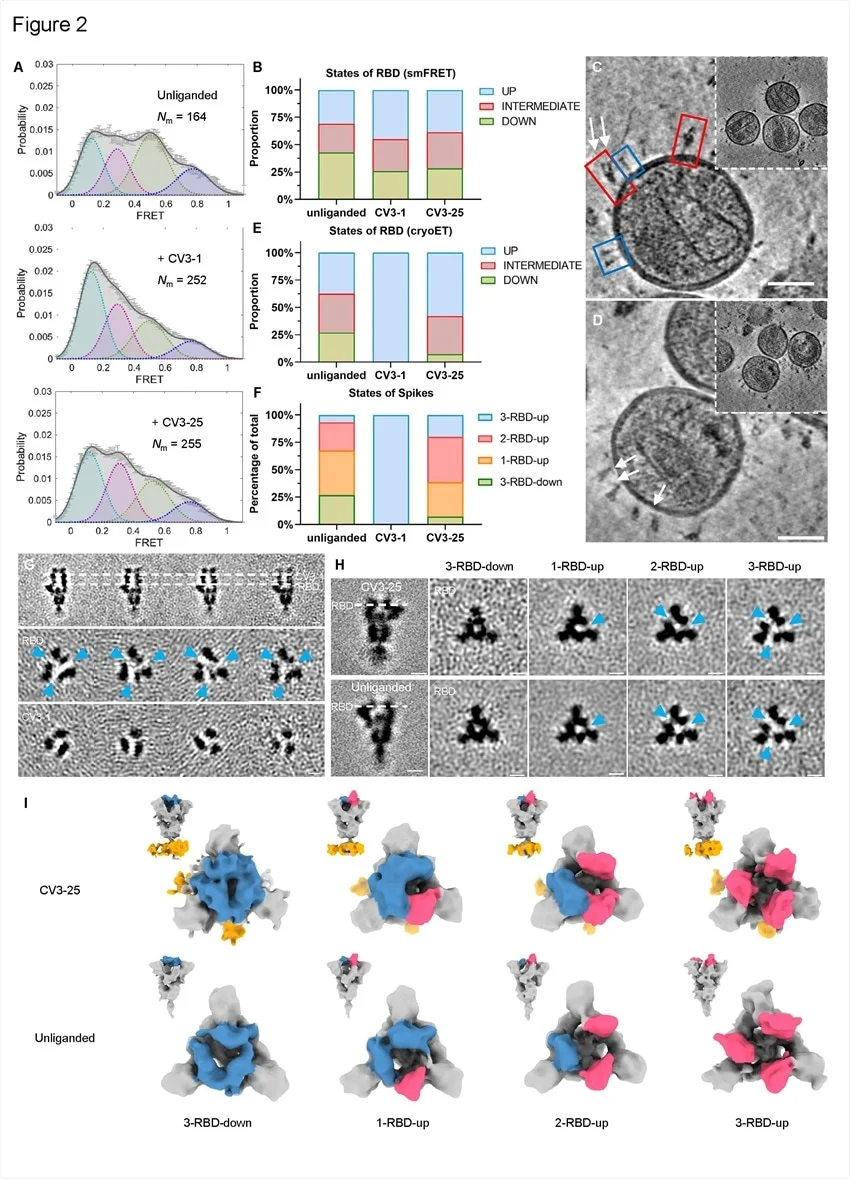 SB. 1.1.7的构象动力学与 CV3-1和 CV3-25结合。(a) SB. 1.1.7的构象状态用 smFRET 监测慢病毒粒子的非连接性,CV3-1和 CV3-25结合 SB. 1.1.7。带有个别动态分子数目(Nm)的 FRET 直方图/踪迹汇编成一个构象-种群 FRET 直方图(灰线) ,并且拟合成一个4态的正态分布(固体黑色) ,中心为0.1-FRET (虚线青色) ,0.3-FRET (虚线红色) ,0.5-FRET (虚线绿色) ,0.8-FRET (虚线品红)。(b)第(a)项中 smFRET 确定的 RBD 不同状态的比例。平行比较的低温数据,0.8-FRET 部分被省略,由于其结构的不确定性。(C-D)带 s 的 SARS-CoV-2假病毒的放大图像,包括 CV3-1(c)和 CV3-25(d) Fabs 及其代表性断层图(insets)。比例尺,50纳米。白色箭头表示被捆绑的 Fabs。红盒子,预熔钉;蓝色的盒子融合后的钉子。(e)根据 cyroET 数据,在不同条件下 RBD 不同状态的比例。通过对 RBD 区域的聚焦分类,将 UP 状态分离出来。剩下的 RBDs 被定义为 DOWN 状态,如果在同一个峰值上没有 up RBD,否则,它们被认为是一个居间态。(f)有和无 Fabs 束缚的病毒上不同 RBD 状态的比例。穗被分为3-RBD-down、1-rbd-up、2-RBD-up 和3-RBD-up 类。(g)由 CV3-1 Fabs 约束的平均 s 亚类的侧视图(顶面图)和顶视图(中底面图)。(h)对 s 的 RBD 进行聚焦分类后,得到了不连续(底部)和 CV3-25界(顶部) s 的一致性结构的侧视图(左列)和子类平均值(右列)的顶视图(右列)。在(G-H)中,虚线表示顶视图部分的位置。蓝色箭头指向 RBD 和邻近的 NTD 之间的密度差距,当 RBD 进入 up- 状态时出现。尺度条,5 nm。(i)非连续(底部)和 CV3-25界(顶部) s 的子类平均分割。顶视图和侧视图(插值)显示了3-RBD-down,1-RBD-up,2-RBD-up 和3-RBD-up 类。向下和向上的 RBDs 分别用蓝色和红色显示,CV3-25 Fabs 用橙色显示。
SB. 1.1.7的构象动力学与 CV3-1和 CV3-25结合。(a) SB. 1.1.7的构象状态用 smFRET 监测慢病毒粒子的非连接性,CV3-1和 CV3-25结合 SB. 1.1.7。带有个别动态分子数目(Nm)的 FRET 直方图/踪迹汇编成一个构象-种群 FRET 直方图(灰线) ,并且拟合成一个4态的正态分布(固体黑色) ,中心为0.1-FRET (虚线青色) ,0.3-FRET (虚线红色) ,0.5-FRET (虚线绿色) ,0.8-FRET (虚线品红)。(b)第(a)项中 smFRET 确定的 RBD 不同状态的比例。平行比较的低温数据,0.8-FRET 部分被省略,由于其结构的不确定性。(C-D)带 s 的 SARS-CoV-2假病毒的放大图像,包括 CV3-1(c)和 CV3-25(d) Fabs 及其代表性断层图(insets)。比例尺,50纳米。白色箭头表示被捆绑的 Fabs。红盒子,预熔钉;蓝色的盒子融合后的钉子。(e)根据 cyroET 数据,在不同条件下 RBD 不同状态的比例。通过对 RBD 区域的聚焦分类,将 UP 状态分离出来。剩下的 RBDs 被定义为 DOWN 状态,如果在同一个峰值上没有 up RBD,否则,它们被认为是一个居间态。(f)有和无 Fabs 束缚的病毒上不同 RBD 状态的比例。穗被分为3-RBD-down、1-rbd-up、2-RBD-up 和3-RBD-up 类。(g)由 CV3-1 Fabs 约束的平均 s 亚类的侧视图(顶面图)和顶视图(中底面图)。(h)对 s 的 RBD 进行聚焦分类后,得到了不连续(底部)和 CV3-25界(顶部) s 的一致性结构的侧视图(左列)和子类平均值(右列)的顶视图(右列)。在(G-H)中,虚线表示顶视图部分的位置。蓝色箭头指向 RBD 和邻近的 NTD 之间的密度差距,当 RBD 进入 up- 状态时出现。尺度条,5 nm。(i)非连续(底部)和 CV3-25界(顶部) s 的子类平均分割。顶视图和侧视图(插值)显示了3-RBD-down,1-RBD-up,2-RBD-up 和3-RBD-up 类。向下和向上的 RBDs 分别用蓝色和红色显示,CV3-25 Fabs 用橙色显示。
虽然目前疫苗引起的免疫反应对所有已知的变种提供了不同程度的保护,但可能需要加强注射,以确保对未来的变种提供足够的保护。
此外,由于 SARS-CoV-2 是继 SARS-CoV-1 和中东呼吸综合征 (MERS) 之后本世纪在人类中出现的第三种 β 冠状病毒,并且鉴于在蝙蝠等野生动物物种中存在大量类似病毒的天然宿主,另一种冠状病毒未来可能会发生大流行。
Mothe 和他的同事说,这些冠状病毒的 S2结构域是高度保守的,这提高了交叉反应抗体和疫苗的可能性。
研究人员之前对从康复期患者中分离出的两种有效的尖峰结合抗体 CV3-1 和 CV3-25 进行了表征。虽然 CV3-1 专门针对 RBD,但 CV3-25 可识别几种β冠状病毒的 S2 域。
首先,该团队测试了抗体识别和中和 B.1.1.7、B.1.351、P.1 和 B.1.617.2 相关变体以及 B.1.429 (epsilon)、B 的能力.1.525 (eta)、B.1.526 (iota) 和 B.1.617.1 (kappa) 感兴趣的变体。
CV3-1 抗体有效地与表达来自这些不同变体的刺突蛋白的细胞结合,并表现出强大的中和活性。
CV3-25抗体的效力较低,但仍能有效地结合和中和所有变异体。
这两种抗体也限制了 K18-hACE2小鼠鼻子和肺部的病毒复制,这些小鼠被注射了致死剂量的 b. 1.351变体。
“这些数据表明,与针对新兴变体减弱的其他抗体相比,CV3-1 和 CV3-25 对这些变体仍然有效,因此是阐明作用模式和鉴定具有泛冠状病毒活性的表位的主要候选者,” Mothes 和同事写道。
接下来,研究人员通过对携带 B.1.1.7 变体的病毒样颗粒 (VLP) 进行冷冻处理,阐明了两种抗体的结构和作用方式。
结果表明,CV3-1与 RBD 的485-GFN-487环结合,形成向上构象,诱导 S1强烈脱落。
“数据表明 CV3-1 是一种有效的激动剂,并指出 485-GFN-487 环是一个对 S1 激活至关重要的变构中心,”该团队说。
相比之下,CV3-25 通过与 S2 茎螺旋区的表位结合来抑制膜融合。
Mothes 及其同事写道:“鉴于茎螺旋表位在 β-冠状病毒中高度保守,具有这种 S2 表位的免疫原是疫苗的有趣候选者,可以覆盖所有变体并可能表现出泛冠状病毒功效。”
研究人员表示,这两种抗体的表位对于针对新兴变体的被动和主动免疫策略都很重要。
“在 RBD 和茎螺旋中包含保守区域的疫苗免疫原设计是引发泛冠状病毒保护性免疫反应的候选者,”他们总结道。
举报/反馈
最近更新热点资讯
- 谷歌AI聊天记录让网友San值狂掉:研究员走火入魔认为它已具备人格,被罚带薪休假
- 豆瓣9.4,姐弟恋、三人行,这部大尺度太厉害
- Genes, Intelligence, Racial Hygiene, Gen
- 【土耳其电影】《冬眠》电影评价: 宛如一部回归伯格曼风格的道德剧
- 陌生人社会伦理问题研究
- 理论研究|前海实践的价值理性和工具理性
- 澳门刑事证据禁止规则
- 综艺普及剧本杀和密室逃脱助力线下实体店爆发式增长
- 日本小伙和五个小姐姐同居?看完我酸了!
- 第一学期高一语文考试期中试卷
- 高中必考的物理公式有哪些
- 这部大尺度的申奥片,却讲述了不lun恋...
- 心理语言学论文精品(七篇)
- 《贵妃还乡》 超清
- 专论 | 郭丹彤、陈嘉琪:古代埃及书信中的玛阿特观念
- 微专业招生 | 数字文化传播微专业列车即将发车,沿途课程抢先看!
- 生态安全的重要性汇总十篇
- 原创因“18禁”电影登舆论顶峰,万千少女一场春梦:这一生,足够了
- 章鱼头
- 读书心得体会
- 考研考北京大学医学部或者协和是一种怎样的难度?
- 央媒评女主播编造“夜宿故宫”:让肇事者付出代价,理所应当
- 库欣病患者求医记(流水账)
- 《太平公主》④ | 地位越高,越要装傻
- 爱体检 安卓版 v2.5
