 手机访问:wap.265xx.com
手机访问:wap.265xx.com抗体工程改造研究,盘一盘 FcRn“新生儿”Fc受体(上篇)
在全球生物制药急速扩张的大背景下,抗体及抗体工程药物在疾病的诊断,治疗和预防方面所占的比重迅速增长。长期以来,抗体药物不可避免的高研发成本所产生的昂贵售价并不很亲民,并且相对频繁的注射给药也给患者带来诸多不便。抗体半衰期是抗体药物代谢动力学的关键,因此,延长抗体半衰期成为抗体工程改造的重点之一。本期小编给大家分享,基于FcRn功能开发的药物研究(延长抗体药物半衰期和自身免疫疾病治疗)。
一、关于抗体
抗体是由B淋巴细胞对外来分子或抗原刺激后产生的Y型免疫球蛋白,其包含两个完全相同的抗原结合片段(fragment antigen binding,Fab)和一个可结晶片段(fragment crystallizable, Fc)。人体内表达的免疫球蛋白(Ig)主要有5种:IgM、IgA、IgD、IgG、IgE。其中,血清中含量最多的免疫球蛋白是IgG,也是抗体药物的主体。
抗体是免疫系统的核心组成部分,可以预防和控制病原体的传播,同时对再次感染提供长期保护。
二、抗体药物重要作用机制
抗体的结构决定其作用机制,抗体的基本结构是由两条重链(Heavy chain)和两条轻链(Light chain),通过链间的二硫键连接而成,呈“Y”字型。
Fab段
其中,Y型结构上面的两个臂为Fab段(VH和VL)(见图1)可以识别游离分子(如VEGF、TNF等)和细胞表面的受体(如CD20、CD19等),达到对外来入侵物(病毒,细菌等)及自身异常细胞如癌细胞的特异性识别,进而调控如癌细胞抗原相关的下游信号通路,从而抑制癌细胞生长,诱导癌细胞分化和凋亡。
Fc段(CH2和CH3)
Fc段决定抗体的效应功能,巨噬细胞、NK细胞等细胞表面的Fc受体为对免疫球蛋白Fc部分C末端的受体。免疫球蛋白(Ig)与抗原结合后,抗体的Fc段变构,与细胞膜上的Fc受体结合,产生各种生物效应,包括抗体依赖性的细胞介导的细胞毒作用(ADCC),抗体依赖性细胞介导的吞噬作用(ADCP),以及补体依赖的细胞毒性作用(CDC)等进一步提高单克隆抗体的疗效。
IgG受体主要有FcRn和FcγRs。其中,FcγRs /C1q与可结晶片段(Fc)区域(图1)相互作用的位点位于下铰链上的CH2(绿色矩形);FcRn与Fc区域相互作用的位点位于CH2、CH3的界面(黄色矩形)。

图1:免疫球蛋白Y整体结构示意图及其与FcγRs/C1q和FcRn的结合区域
此外,FcRn与IgG的结合呈pH依赖性(pH dependence),这是FcRn实现IgG的跨膜转运及维持血浆IgG水平稳态的基础。
三、基于FcRn功能开发的药物设计
新生儿Fc受体(FcRn)是一个非常优质的载体膜蛋白,广泛参与了体内各种生物学及免疫过程。基于FcRn的药学研究主要集中与融合蛋白,IgG的Fc段工程化改造以及用于靶向FcRn药物递送应用的研究和FcRn抗体的研发。
Fc与FcRn以pH依赖的方式相互作用,可以减缓IgG的降解,延长其血清半衰期;抗体Fc区域的缺失也大大缩短了其血清半衰期,削弱了其药效作用。
除了半衰期评估,FcRn作为靶点的潜力也相当巨大,主要因为FcRn的高亲和力尤其对IgG介导自身免疫性疾病造成有害影响。靶向FcRn,抑制FcRn循环可使IgG分解代谢增强,导致整体IgG和致病自身抗体水平降低,有望降低IgG引起的自身免疫异常,从而达到治疗自身免疫疾病的作用。
FcRn的结构与功能
FcRn(neonatal Fc receptor,新生儿受体)是一种位于细胞膜表面的IgG抗体受体,其蛋白结构和MHC-I类分子类似,其结构包含由α链(α1,α2和α3)和β2微球蛋白组成的异二聚体;FcRn可以与IgG以及白蛋白结合,但是结合的位点不同,分别位于α链的内测和外侧(图2)。
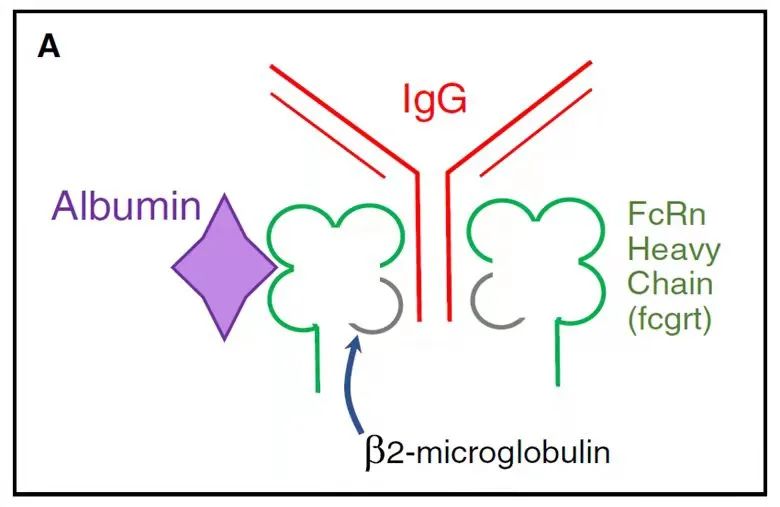

图A 图B
图2:FcRn与IgG及白蛋白结合的结构示意图
由图2(A/B)结构示意图可见:人IgG1(红色)通过其Fc端CH2–CH3域与FcRn的α2域(绿色)和β2M(灰色)的N端相结合。人血清白蛋白(紫色)在其他结合域与FcRn结合。平衡条件下,FcRn与IgG以2:1的比例结合,不平衡条件下,FcRn与IgG以1:1的比例结合;白蛋白在其他位点与FcRn以1:1的比例结合。由此可见,FcRn与IgG和血清白蛋白的结合位点并不相同,因此FcRn与IgG结合不会受到血清蛋白的干扰。
FcRn与抗体半衰期的关系
IgG在人体内半衰期长达2-4周,影响半衰期主要归因于FcRn介导的再循环机制,而这种机制是通过IgG的Fc片段和血清白蛋白与FcRn的pH依赖性结合而实现。在酸性条件下(pH6.0-6.5),FcRn结合IgG,在中性及弱碱性条件下(pH7.0-7.5)发生解离(图3)。

图3:FcRn对IgG的循环示意图
内皮细胞通过形成内吞小泡,将IgG摄取后形成酸化内体。IgG与FcRn结合形成IgG-FcRn复合物。IgG-FcRn复合物通过再循环内体转运到细胞表面,由于细胞外血液的pH值为微碱性pH7.4左右,IgG-FcRn复合物发生解离,IgG重新释放至血液循环中,通过这种受体介导的再循环机制,FcRn有效保护IgG避免在溶酶体中降解,从而延长IgG的半衰期。而酸化内体中未与FcRn结合形成IgG-FcRn复合物的IgG,则在溶酶体内发生降解。应用FcRn对IgG的循环机制延长抗体药物在体内的半衰期是目前应用较广泛的方法。
基于上述的循环机制,对抗体的Fc序列进行改造可以进一步优化抗体的药代动力学特征。可以采用氨基酸点突变,噬菌体展示,酵母展示,细胞展示及计算机辅助设计等方法,构建和筛选Fc突变体,优化pH依赖性的Fc-FcRn相互作用,使其在pH6.0条件下结合力更强,而在pH7.4条件下Fc能从FcRn上迅速解离,避免被溶酶体等降解,实现改造的目的。
2018年FDA批准了Fc工程化突变体药物Ravulizuma-cwvz,是一种补体C5抑制剂,由Alexion制药公司开发,用于治疗阵发性夜间血红蛋白尿(PNH)和非典型溶血性尿毒综合征(aHUS)。该药物是通过对Eculizumab中加入了两个结构变化,在Fc区进行两个氨基酸替换,增强了抗体对人FcRn的亲和力,以创造一种新的长效抗体。Eculizumab需要每2-3周静脉输注一次,增加了输注负担和相关不良事件,而Ravulizumab半衰期长达42天, 患者只需每8周接受1次静脉注射治疗。此外,Xencor的LS变体 (M428L/N434S),pH6.0 时与FcRn的亲和力提高了11倍, 突变体M252Y/S254T/T256E(YTE)与hFcRn的结合亲和力提高了10倍。使用这些突变技术,MEDI-524-YTE在食蟹猴体内半衰期延长近 4倍。抗体药物motavizumab-YTE在人体内的半衰期可达100天。由此可见,通过FcRn对IgG的循环机制,对抗体的Fc序列的改造可以很大程度上延长药物半衰期,对患者用药可以减少其用药次数。
通过上述机制的启发,新为医药根据FcRn对IgG的保护机制,利用ASyNaL纳米抗体筛选平台(噬菌体展示技术),对Fc段进行改造,构建Fc突变体文库,通过FcRn对Fc突变体文库进行筛选,获得了一系列与FcRn亲和力相对较高的Fc突变体,在不同的pH值条件下,通过BLI测定其亲和力。最后筛选到多个高亲和力的Fc突变体。为后续新为医药所筛选到的其他药物延长其半衰期做准备。
举报/反馈
最近更新热点资讯
- 谷歌AI聊天记录让网友San值狂掉:研究员走火入魔认为它已具备人格,被罚带薪休假
- 豆瓣9.4,姐弟恋、三人行,这部大尺度太厉害
- Genes, Intelligence, Racial Hygiene, Gen
- 【土耳其电影】《冬眠》电影评价: 宛如一部回归伯格曼风格的道德剧
- 陌生人社会伦理问题研究
- 理论研究|前海实践的价值理性和工具理性
- 澳门刑事证据禁止规则
- 综艺普及剧本杀和密室逃脱助力线下实体店爆发式增长
- 日本小伙和五个小姐姐同居?看完我酸了!
- 第一学期高一语文考试期中试卷
- 高中必考的物理公式有哪些
- 这部大尺度的申奥片,却讲述了不lun恋...
- 心理语言学论文精品(七篇)
- 《贵妃还乡》 超清
- 专论 | 郭丹彤、陈嘉琪:古代埃及书信中的玛阿特观念
- 微专业招生 | 数字文化传播微专业列车即将发车,沿途课程抢先看!
- 生态安全的重要性汇总十篇
- 原创因“18禁”电影登舆论顶峰,万千少女一场春梦:这一生,足够了
- 章鱼头
- 读书心得体会
- 考研考北京大学医学部或者协和是一种怎样的难度?
- 央媒评女主播编造“夜宿故宫”:让肇事者付出代价,理所应当
- 库欣病患者求医记(流水账)
- 《太平公主》④ | 地位越高,越要装傻
- 爱体检 安卓版 v2.5
