 手机访问:wap.265xx.com
手机访问:wap.265xx.comScience:我国科学家揭示人类卵母细胞无中心体纺锤体组装机制
纺锤体组装对于确保减数分裂和有丝分裂中染色体的准确传递至关重要。在体细胞中,有丝分裂纺锤体组装是由重复的中心体(centrosome)介导的,但许多物种的卵母细胞中没有典型的中心体。在啮齿类动物中,无中心体微管组织中心(acentriolar microtubule organizing centers,aMTOC)负责减数分裂纺锤体组装,但长期以来人们认为人类卵母细胞在减数分裂纺锤体上缺乏显著的aMTOC,而且人类卵母细胞中无中心体纺锤体组装的确切机制一直不清楚。

微管成核和确保纺锤体组装是调节卵母细胞核成熟的核心事件。在一项新的研究中,为了确定驱动人类卵母细胞中纺锤体微管成核的潜在蛋白,来自中国复旦大学和上海交通大学的研究人员通过免疫荧光或三维高分辨率活细胞成像在2000多个人类卵母细胞中系统地定位了86种人类中心体和微管相关蛋白。他们随后跟踪了在细胞核膜分解(nuclear envelope breakdown, NEBD)前后不同时间点上确定的微管成核物(microtubule nucleator)的动态迁移。他们进一步下调了相应的蛋白,以确认它们在微管核和纺锤体组装中的作用。鉴于纺锤体微管成核缺陷会导致纺锤体组装受损和卵母细胞成熟异常,他们在1394名存在卵母细胞成熟阻滞的不孕女性患者队列中筛选了编码微管成核物组分的基因发生的突变。相关研究结果发表在2022年11月18日的Science期刊上,论文标题为“The mechanism of acentrosomal spindle assembly in human oocytes”。
首先,这些作者发现在人类卵母细胞中,纺锤体微管成核是在细胞核膜分解2至4小时后从动粒(kinetochore)开始的。他们展示了人类卵母细胞中纺锤体微管从动粒成核的过程。他们接着发现有43种蛋白定位于减数分裂纺锤体,其中4种蛋白--- CCP110、CKAP5、DISC1和TACC3---表现出动粒和纺锤体微管定位。这四种蛋白的定位与它们在人类有丝分裂细胞和小鼠卵母细胞中的定位明显不同。就在细胞核膜分解之前,这四种蛋白一起在人类生发泡(germinal vesicle, GV)卵母细胞中形成了一种不寻常的被微管包围的结构。他们将这种潜在的成核结构称为人类卵母细胞微管组织中心(human oocyte microtubule organizing center, huoMTOC)。他们发现在人类生发泡卵母细胞的皮层形成了单个huoMTOC,并在细胞核膜分解之前迁移到细胞核膜。在细胞核膜分解之后,huoMTOC变得支离破碎,并被招募到动粒上以启动纺锤体微管成核。huoMTOC组分的下调表达导致人类卵母细胞中的纺锤体微管成核和纺锤体组装明显受损。这种结构在诸如小鼠和猪之类的其他哺乳动物物种的卵母细胞中没有检测到。他们最终确定了两名卵母细胞成熟阻滞患者,她们的huoMTOC关键组分TACC3发生了复合杂合突变。所有的突变都破坏了TACC3的正常功能,导致这两名患者的卵母细胞中没有huoMTOC结构,纺锤体组装完全受损。
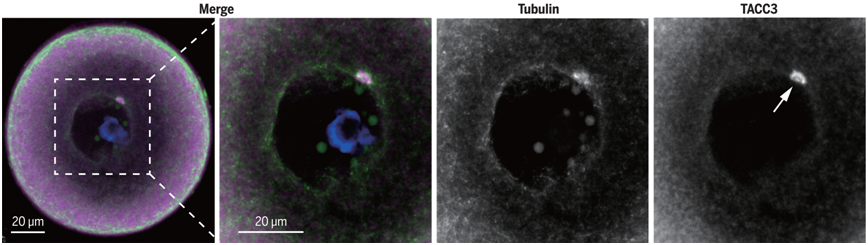
人类卵母细胞中的 huoMTOC结构。图片来自Science, 2022, doi:10.1126/science.abq7361。
综上所述,这项新的研究表明人类卵母细胞拥有一种类似aMTOC的结构,即huoMTOC,它是微管成核的主要位点,也是纺锤体组装所必需的。与小鼠卵母细胞中的aMTOC相比,huoMTOC在数量、定位和组成方面显示出截然不同的特征。这些发现表明人类卵母细胞已经进化出一种不同的微管成核和纺锤体组装的启动机制。这些作者发现TACC3突变通过破坏huoMTOC的结构导致纺锤体组装缺陷,从而导致临床上卵母细胞成熟阻滞。这表明huoMTOC可能是评估人类卵母细胞质量的一种重要的生物标志物。
这些作者对huoMTOC的发现为人类卵母细胞中微管成核和纺锤体组装的生理机制提供了深入的了解。这些发现也增强了科学家们对卵母细胞成熟阻滞的病理机制的理解。(生物谷 Bioon.com)
参考资料:
Tianyu Wu et al. The mechanism of acentrosomal spindle assembly in human oocytes, Science, 2022, doi:10.1126/science.abq7361.
上一篇:奥密克戎新毒株不断出现,如何应对新冠二次感染率持续上升?
下一篇:阳性感染者什么情况下可返岗复工?北京发布会回应→
最近更新热点资讯
- 谷歌AI聊天记录让网友San值狂掉:研究员走火入魔认为它已具备人格,被罚带薪休假
- 豆瓣9.4,姐弟恋、三人行,这部大尺度太厉害
- Genes, Intelligence, Racial Hygiene, Gen
- 【土耳其电影】《冬眠》电影评价: 宛如一部回归伯格曼风格的道德剧
- 陌生人社会伦理问题研究
- 理论研究|前海实践的价值理性和工具理性
- 澳门刑事证据禁止规则
- 综艺普及剧本杀和密室逃脱助力线下实体店爆发式增长
- 日本小伙和五个小姐姐同居?看完我酸了!
- 第一学期高一语文考试期中试卷
- 高中必考的物理公式有哪些
- 这部大尺度的申奥片,却讲述了不lun恋...
- 心理语言学论文精品(七篇)
- 《贵妃还乡》 超清
- 专论 | 郭丹彤、陈嘉琪:古代埃及书信中的玛阿特观念
- 微专业招生 | 数字文化传播微专业列车即将发车,沿途课程抢先看!
- 生态安全的重要性汇总十篇
- 原创因“18禁”电影登舆论顶峰,万千少女一场春梦:这一生,足够了
- 章鱼头
- 读书心得体会
- 考研考北京大学医学部或者协和是一种怎样的难度?
- 央媒评女主播编造“夜宿故宫”:让肇事者付出代价,理所应当
- 库欣病患者求医记(流水账)
- 《太平公主》④ | 地位越高,越要装傻
- 爱体检 安卓版 v2.5
