 手机访问:wap.265xx.com
手机访问:wap.265xx.com单域抗体的免疫原性和人源化
前 言
单域抗体(sdAbs)是骆驼重链抗体和鲨鱼重链抗体的自主可变结构域,作为生物药物的组成部分具有许多理想的特性。然而,它们的序列可能会增加人体免疫原性和抗药物抗体(ADA, antidrug antibody)的风险,因此,sdAbs在开发过程中通常被人源化。Martin A. Rossotti等回顾和总结了有关sdAbs免疫原性的案例,以及我们目前通过人源化降低免疫原性风险的策略的知识现状。
VHHs和VNARs具有许多优良的特性,比如它们的模块化:它们严格的单体行为使其成为构建多价和多特异性治疗和诊断分子的最佳模块,但当作为治疗药物使用时,可能会增加不必要的免疫反应。
sdAbs的一些内在特征可能降低免疫原性:包括尺寸小,即具有免疫原性的表位数量少,形成高免疫原性聚集物的概率低,以及在血液中半衰期较短可以被快速清除等。大多数VHHs与人类IGHV3家族基因序列同源性较高(FR序列同源性高达95%)并与人源化小鼠VH结构域(如曲妥珠单抗)相似,有望转化为低免疫原性。
虽然VHHs的CDR1和CDR2环具有与人类抗体相似的经典结构,但是在它们的长CDR3环可能存在人类序列中缺失的构象。VHHs中CDRs和FRs的高水平的体细胞高突变可能会降低它们与人类IGHV3基因产物的序列同源性。除此之外,具有免疫原性的构象表位也可能是由非典型二硫键引起的sdAb结构域的微妙变化而形成的。
抗体免疫原性的临床前分析
抗体治疗药物开发过程中,抗体的免疫原性可以通过几种方法进行评估。 首先,可以通过大量不同志愿者的血清样本来评估血液中先前存在的ADAs。这种方法简单,但通常需要设计和验证单个抗体的定制结合分析,这种分析不便与对不同抗体产生的ADAs进行准确的比较。第二,可以基于实验数据进行计算机分析(https://www.iedb.org/),通过CD4+T细胞表位(TCEs)的存在来预测抗体的免疫原性,这些表位与持续的ADAs产生有关。但这种分析可能高估了假定的免疫原性区域的数量,因此在计算机TCEs预测中,最终会使用基于细胞的分析来验证。第三,体外免疫分析可以帮助识别任何TCEs的存在。为此目的,已经开发了多种分析和筛选平台,包括HLA肽结合试验、T细胞表位肽筛选试验和全蛋白体外T细胞活化试验,发现TCEs主要出现在互补区CDR而不是框架区FR。最后,免疫原性也可以通过给药实验动物(如小鼠或非人灵长类动物)来评估,但这种方法不能很准确的预测人体内免疫原性。
VHHs的免疫原性
VHHs临床开发的先驱之一是比利时生物制药公司Ablynx。该公司于2018年被赛诺菲收购。在他们被收购的时候,Ablynx至少有8个基于VHHs的临床项目和许多其它在临床前后期或研发阶段早期。Ablynx大部分的临床项目都是基于人源化的VHHs。并且,由Ablynx主导研发的卡普拉西单抗于2018年获得EMA批准,并于2019年获得FDA批准,用于血栓性血小板减少性紫癜和血栓形成的治疗。
目前尚无VHHs及其人源化衍生物的免疫原性的临床前研究的发表。仅有的临床前VHHs体外免疫原性研究是两个非人源化的项目,抗人表皮生长因子受体2(HER2)和抗巨噬细胞甘露糖受体,这两个项目均进入二期临床。两种VHHs均无聚集物,并被树突状细胞(DCs)吸收,但在共培养中未能激活树突状细胞或T细胞。
截至2020年,已至少进行有35项基于VHHs的生物药物的临床试验,涉及1000多名患者和健康志愿者。VHHs与全人或人源化IgGs相比,大多数试验显示VHHs没有或只引起最小的免疫原性,而后者在0-30%的受试者中观察到短暂的治疗期ADAs,中和ADAs小于3%。在一项68Ga标记的抗HER2单峰骆驼VHH乳腺癌PET/CT成像的I期试验中,20例患者在单次注射后没有一例出现ADAs。随后的一项研究发现,1/20的患者血液中先前存在的ADAs水平较低,在注射后3个月内略有增加,但没有安全性和PK相关的不良反应。与大多数VHHs观察到的最小免疫原性相比,在一项针对死亡受体5(DR5)的四价人源化骆驼VHH(TAS266)的I期安全性和耐受性研究中描述了意外的肝毒性。表1总结了近年来单域抗体免疫原性评估结果。
表1 sdAb免疫原性评估结果总结
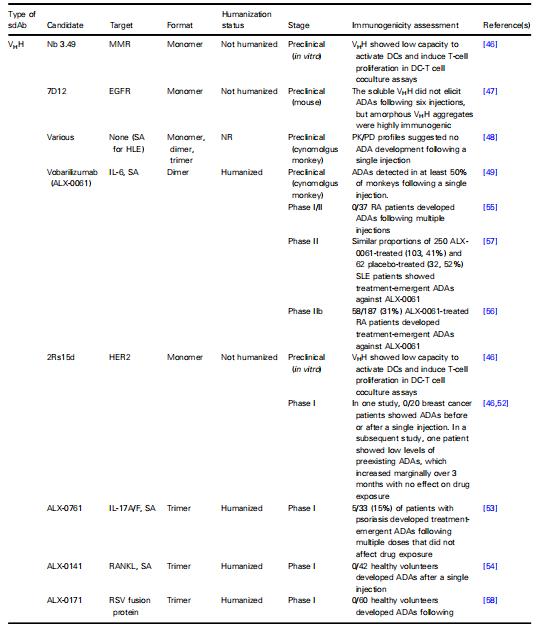
aTTP, acquired thrombotic thrombocytogenic purpura; CD40L, CD40 ligand; DC, dendritic cell; GLP1R, glucagon-like peptide 1 receptor; HLE, half-life extension; IL, interleukin; MMR, macrophage mannose receptor; NR, not reported; RANKL, receptor activator of nuclear factor-jΒ ligand; RSV, respiratory syncytial virus; SA, serum albumin; SLE, systemic lupus erythematosus; TNFR1, tumor necrosis factor receptor 1; TNF-a, tumor necrosis factor-a; VEGF, vascular endothelial growth factor; vWF, von Willebrand factor.
降低sdAbs免疫原性的策略
尽管VHHs和VNARs的免疫原性预期较低,但仍有免疫原性的潜在风险,为避免导致ADAs对药物疗效产生不利影响,对VHHs进行人源化改造是其开发应用过程中常规流程部分。
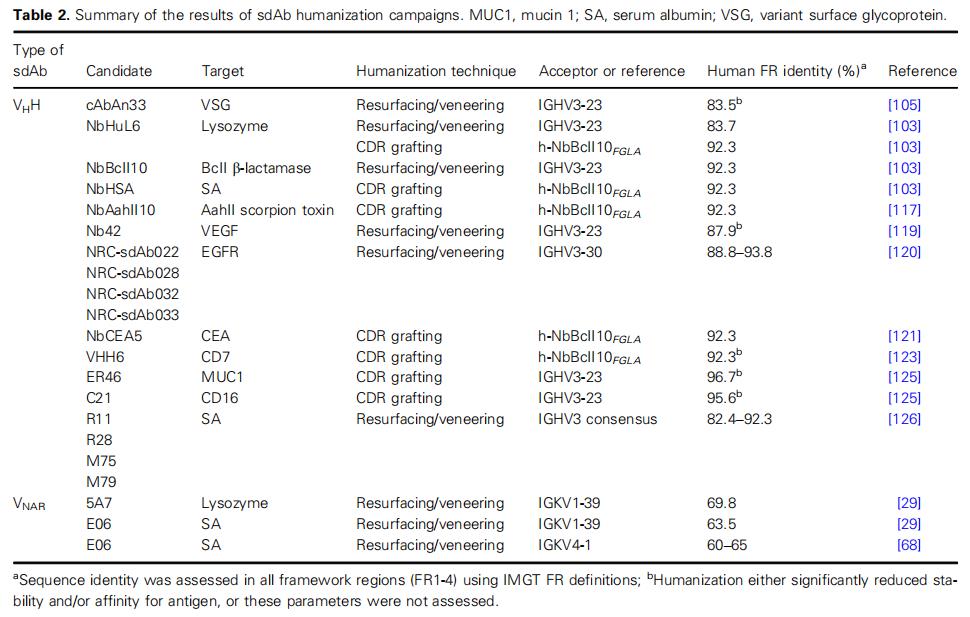
人源化改造是将抗体可变结构域FRs中异种序列替换为人源序列。目前VHH或VNAR人源化的技术包括表面重塑(Resurfacing)和CDR移植(CDR grafting)。
表面重塑是仅将非人源抗体表面暴露的FRs残基替换为来自人源抗体FRs的相应残基。表面重塑旨在对亲本抗体的特异性产生最小的影响。
CDR移植是第一种用于治疗性抗体人源化的方法,它是将异种抗体的CDRs移植到人源FRs中的过程。CDR移植抗体的设计对于保持亲本抗体的亲和力和特异性至关重要:CDR边界、人源框架以及人源FRs对非人源抗体序列的反向突变的选择对于获得最佳的人源化结果至关重要。
首先,sdAsb序列与人种系IGHV基因数据库(或在VNARs的情况下,与轻链可变基因)比对。然后将选定的人源V序列作为参考,修饰sdAbs FRs中固定位置的氨基酸,这些氨基酸对VHHs和VNARs的稳健特性破坏最小。一般来说,主要负责VHHs溶解度的FR2结构域中的4个亲水性氨基酸中的2个氨基酸可以被置换(IMGT位置49和50),置换后的抗体溶解度和功能也不会受影响;而另外2个氨基酸(IMGT位置42和52)对维持VHHs的结构完整性至关重要,因此必须保留。尽管有这种限制,与人源化小鼠VH结构域相比,人源化VHHs与人IGHV基因产物具有更高的序列同源性。完全人源化的VHHs和VNARs有时是通过同时引入所有氨基酸交换而产生的,但是这种人源化改造会对表达产量、聚集行为和抗原识别产生不同程度的影响。另外由于一些VHHs使用FR结构域的残基也参与了抗原接触,人源化改造会产生一些不可预测的影响。
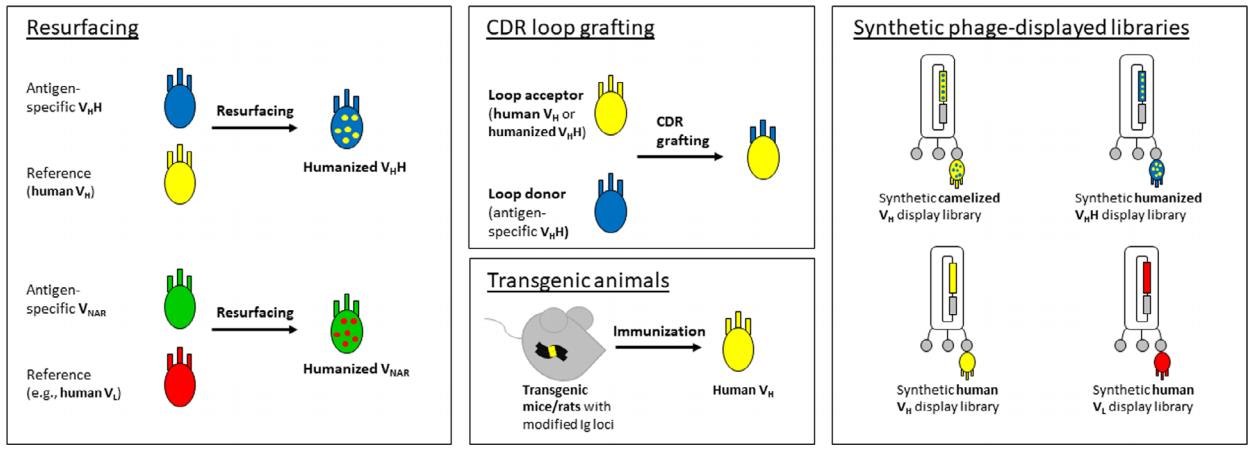
图1 降低sdAbs抗体免疫原性的主要策略。骆驼VHHs和鲨鱼VNARs的人源化可以使用同源的人类可变域作为参考进行表面置换(Resurfacing); 也可以通过将其CDR移植(CDR grafting)到合适的受体支架上(先前人源化的VHH/VNAR或人VH)来实现。
小 结
与传统抗体相比,sdAbs抗体的免疫原性数据相对有限。现有数据表明,控制sdAbs免疫原性的策略与常规抗体相同,包括序列改造、剂量调整、给药途径等因素。虽然长期、高剂量的sdAbs治疗慢性疾病可能会引起不同程度的ADAs,但是临床试验数据的结果显示,sdAbs引起的ADAs频率与人源化或全人源抗体引起的ADAs频率相当。一级氨基酸序列人源化差异并不是sdAbs的免疫原性的主要决定因素,sdAbs人源化改造后引起的抗体低水平聚集也可能增加免疫原性。因此sdAbs人源化改造之后带来的影响还需要更多相关研究。关于VHHs和VNARs的人源化策略的研究工作为开发单域抗体的临床应用提供了宝贵的参考价值,有助于在不影响亲和力、稳定性或溶解度的情况下最大限度地提高人源序列含量。
纳米抗体人源化服务
免疫原性即抗原具有够刺激机体产生抗体或致敏淋巴细胞的能力。在药物研发中,抗体免疫原性严重影响着抗体治疗的安全性和疗效。在临床研究中,不乏因抗药物抗体引起的疗效降低和不良反应,导致多年研发的产品被迫宣告失败的案列。阿帕克生物采用AI技术,模拟所有人源化组合的可能,评估打分,精确指导抗体人源化,成功率100%。
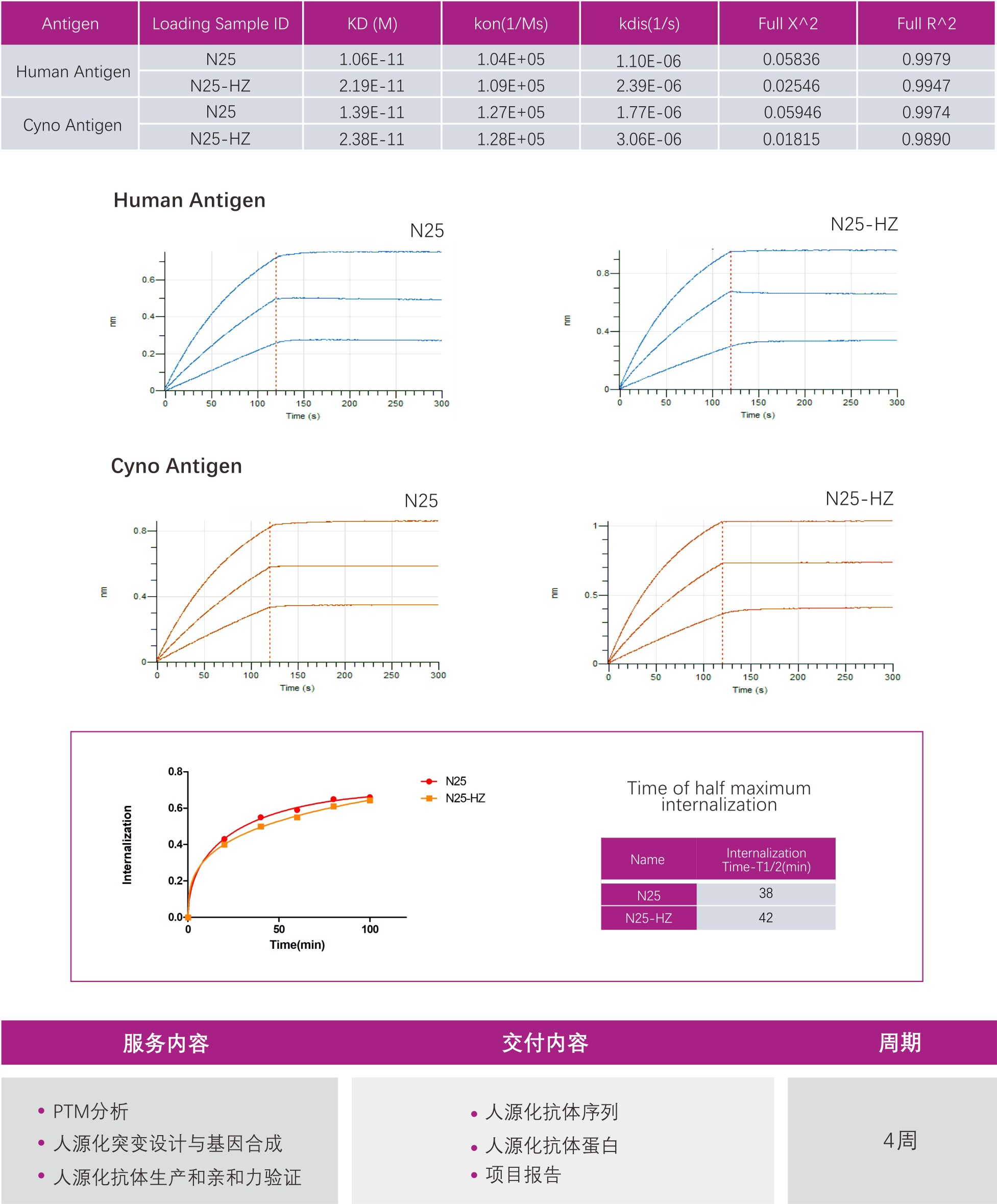
项目案例-纳米抗体人源化
案例一:
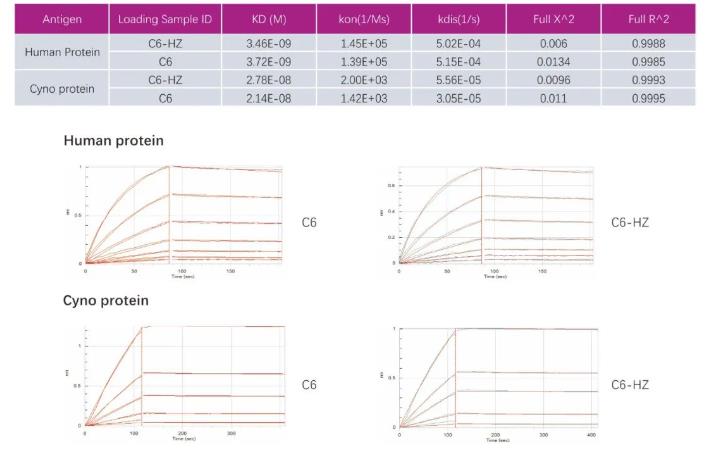
案例二:
最近更新热点资讯
- 谷歌AI聊天记录让网友San值狂掉:研究员走火入魔认为它已具备人格,被罚带薪休假
- 豆瓣9.4,姐弟恋、三人行,这部大尺度太厉害
- Genes, Intelligence, Racial Hygiene, Gen
- 【土耳其电影】《冬眠》电影评价: 宛如一部回归伯格曼风格的道德剧
- 陌生人社会伦理问题研究
- 理论研究|前海实践的价值理性和工具理性
- 澳门刑事证据禁止规则
- 综艺普及剧本杀和密室逃脱助力线下实体店爆发式增长
- 日本小伙和五个小姐姐同居?看完我酸了!
- 第一学期高一语文考试期中试卷
- 高中必考的物理公式有哪些
- 这部大尺度的申奥片,却讲述了不lun恋...
- 心理语言学论文精品(七篇)
- 《贵妃还乡》 超清
- 专论 | 郭丹彤、陈嘉琪:古代埃及书信中的玛阿特观念
- 微专业招生 | 数字文化传播微专业列车即将发车,沿途课程抢先看!
- 生态安全的重要性汇总十篇
- 原创因“18禁”电影登舆论顶峰,万千少女一场春梦:这一生,足够了
- 章鱼头
- 读书心得体会
- 考研考北京大学医学部或者协和是一种怎样的难度?
- 央媒评女主播编造“夜宿故宫”:让肇事者付出代价,理所应当
- 库欣病患者求医记(流水账)
- 《太平公主》④ | 地位越高,越要装傻
- 爱体检 安卓版 v2.5
