 手机访问:wap.265xx.com
手机访问:wap.265xx.com2020年Trodelvy等9款抗癌新药重磅上市!
曾经,癌症是不治之症。
在人类与癌症的斗争中,药物治疗是一个很重要的措施,有效的抗癌药物,可以帮助患者获得治愈的机会和更长的生存时间。
我们处在一个充满奇迹的时代,快速发展的医疗科技给人类带来了新的希望。目前全球各国已批准上市的抗癌药物大约有130~150种。用这些药物配制成的各种抗癌药物制剂大约有1300~1500种。

2020年无论是国内还是国外,抗癌药的获批上市都呈井喷状态。下面小编整理了一份国外已上市、国内还没上市的癌症药物供大家参考一下:
01、火遍癌友圈的LOXO-292震撼上市!靶向三大癌症
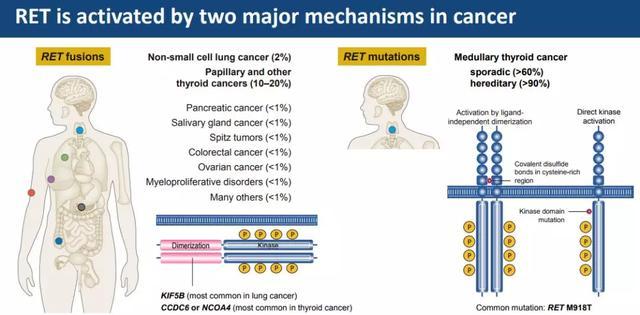
2020年5月8日,传奇抗癌药LOXO-292加速获批上市了,同时也有了自己的大名-Retevmo,不得不说,这款对于RET基因融合的患者有着显著疗效的广谱抗癌药将给病友们带来全新的选择和希望。
Retevmo也是首个被批准专门用于治疗携带RET基因变异的癌症患者的精准疗法。
药物名称:Selpercatinib(LOXO-292,塞尔帕替尼)
商品名称:Retevmo
生产厂家:礼来
优先审批时间:2020年1月30日
FDA预计裁定时间:第三季度
FDA批准时间:2020年5月8日加速获批
药品价格:20,600美元/月
获批适应症:
1)转移性RET 融合阳性非小细胞肺癌,需要系统治疗,并已在铂类化疗和抗PD-1或抗PD-L1治疗后进展的患者;
2)需要全身治疗的RET突变型甲状腺髓样癌(MTC),已在先前治疗后进展,并且没有可接受的替代治疗选择的患者;
3)需要全身治疗的晚期RET融合阳性甲状腺癌,在先前的治疗后已有进展,并且没有可接受的替代治疗选择。
获批数据:此次获批是基于I / II LIBRETTO-001试验数据,该试验评估了LOXO-292在RET改变的非小细胞肺癌和甲状腺癌中的作用,入组的患者每天两次口服160 mg LOXO-292,直至出现不可接受的毒性或疾病进展,主要研究目的是总体缓解率(ORR)和缓解持续时间。
非小细胞肺癌组:对于105例经过至少三种全身性治疗的晚期患者,总的客观缓解率(ORR)能达到64%,其中81%的患者持续应答≥6个月。
甲状腺髓样癌组:143例是既往接受过卡博替尼,凡德他尼(vandetanib)治疗的非常晚期的55位患者中,客观缓解率(ORR)为69%,有76%的患者持续缓解时间≥6个月。甲状腺组:8例只接受过放射性碘治疗的患者的客观缓解率(ORR)竟然高达100%,75%患者持续缓解时间至少6个月。
由此数据可以看出,LOXO-292疗效显著优于目前已获批的多靶点RET靶向药(如卡博替尼,凡德他尼等),与在研的RET靶向药BLU-667(Pralsetinib)相比疗效也不相伯仲,或将成为RET阳性患者的一线推荐方案。
作用靶点:
Selpercatinib是一种高度选择性和有效的口服研究药物,可用于治疗RET激酶异常突变的癌症患者。
RET激酶的基因组改变包括融合和点突变,这导致RET信号过度活跃从而让癌细胞生长不受控制。据统计,在非小细胞肺癌里面,大约1%-2%的患者有RET基因融合,多为与KIF5B基因的融合;在甲状腺髓样癌中超过60%的患者有RET基因突变;在乳头状甲状腺癌中10%的患者有RET基因融合。所以大家做过多基因检测的患者,可以先看看是否有这个RET基因突变或者融合,一旦这款药物上市,大家就有新希望啦!
比如这位患者,先前经过化疗,免疫治疗和靶向治疗共15轮治疗,后来基因检测发现除KIF5B-RET融合外还出现RET V804L突变,接受Loxo-292治疗8周后疾病出现迅速缓解,截至案例发表时已持续治疗11个月仍在继续接受治疗。
02、缓解率达68%!FDA批准首款MET抑制剂卡马替尼上市
卡马替尼作为一种口服的高选择性小分子MET抑制剂,于2020年5月6日被美国FDA批准上市。最重要的是,卡马替尼(Tabrecta、capmatinib、INC280)是FDA批准的针对局部晚期或转移性MET 14跳跃突变的非小细胞肺癌(NSCLC)患者的首款靶向药。
药物名称:Capmatinib(卡马替尼 INC280)
生产厂家:诺华
优先审批时间:2020年2月11日
FDA预计裁定时间:6个月内
FDA批准时间:2020年5月6日加速获批
适应症:治疗携带MET外显子14跳跃突变的转移性非小细胞肺癌(NSCLC)患者,包括一线治疗(初治)患者和先前接受过治疗(经治)的患者。
获批数据:
此次批准是基于II期临床研究GEOMETRY mono-1的阳性结果,共97例患者入组:
(1)在初治患者(28例,先前没有接受过治疗)中,总缓解率(ORR)为67.9%,疾病控制率(DCR)为96.4%,中位缓解持续时间(DOR)为11.14个月,中位无进展生存期为9.69个月。
(2)在经治患者(69例,先前已接受过治疗,88.4%含铂化疗)中,总缓解率ORR为40.6%,疾病控制率(DCR)为78.3%,中位缓解持续时间DOR为9.72个月,中位无进展生存期为5.42个月。
(3)约有一半的脑转移患者对capmatinib应答(13人中有7人;54%)。在这些患者中,有4例完全消除了脑部病变(31%),颅内疾病控制率DCR为92.3%(12/13)。
作用靶点:
METex14突变是公认的致癌驱动因素。诺华与Foundation Medicine合作,正在开发针对卡马替尼的伴随诊断剂,用于肿瘤组织和液体活检,将包括在FoundationOneCDx以及即将推出的Foundation Medicine液体活检平台中,目前正在接受FDA审查。
而在今年ACR大会上,Edward B. Garon博士也在研究中指出,建议患者早期治疗时应进行的基因检测,再选择对症的治疗方案。
03、免疫黄金组合O+Y跻身肺癌一线治疗
5月15日,百时美施贵宝(BMS)公司宣布,美国食品和药物管理局(FDA)已经批准PD-1免疫检查点抑制剂Opdivo(欧狄沃,nivolumab,纳武利尤单抗)联合CTLA-4抑制剂Yervoy(伊匹木单抗,ipilimumab,易普利姆玛)及有限疗程的含铂双药化疗用于一线治疗无EGFR基因突变和ALK融合的转移性或复发性非小细胞肺癌(NSCLC)。
这一喜讯表明Opdivo与低剂量Yervoy联合一定疗程的化疗,能够在一线治疗中为非小细胞肺癌患者带来生存获益。
药物名称:Nivolumab / Ipilimumab
生产厂家:百时美施贵宝
优先审批时间:2020年1月16日
DA预计裁定时间:2020年5月15日前
FDA批准时间:2020年5月15日
适应症:
PD-1免疫检查点抑制剂Opdivo(欧狄沃,nivolumab,纳武利尤单抗)联合CTLA-4抑制剂Yervoy(伊匹木单抗,ipilimumab,易普利姆玛)及有限疗程的含铂双药化疗用于一线治疗无EGFR基因突变和ALK融合的转移性或复发性非小细胞肺癌(NSCLC)。
获批数据:
此次获批是基于CheckMate227三期研究结果,结果显示,
在PDL1≥1%患者中,O药+伊匹的中位OS(总生存期)明显优于化疗,为17.1 vs 14.9个月。
PDL1<1%人群中,O药+伊匹的中位OS也优于化疗,延长了5个月(17.2 vs 12.2个月)。
亚组分析显示,无论PDL1表达及TMB高低,双免疫的OS都优于化疗。
因此,这款联合疗法将让NSCLC患者无论PDL1表达高低,都可以做到去化疗。调整后的双免疫方案毒性也低于化疗。
伴随诊断:
FDA同时批准了PD-L1 IHC 28-8 pharmDx测试作为伴随诊断,以识别适合接受双重免疫治疗方案的患者。

04、非小细胞肺癌再添一线新疗法!T药单药提前获批
5月19日,罗氏(Roche)宣布,美国FDA批准其重磅PD-L1抑制剂Tecentriq(atezolizumab)上市,作为一线单药疗法,治疗PD-L1高表达,且无EGFR或ALK基因突变的晚期非鳞状和鳞状非小细胞肺癌(NSCLC)患者。这是Tecentriq在非小细胞肺癌领域获得的第四个适应症。
阿特珠单抗(Atezolizumab)是一种单克隆抗体,可靶向PD-L1蛋白。阿特朱单抗与肿瘤细胞和肿瘤浸润性免疫细胞上表达的PD-L1结合,阻断其与PD-1和B7.1受体的相互作用。通过抑制PD-L1,可以激活T细胞消灭肿瘤细胞。
目前,Tecentriq已经在中国获批上市(阿替利珠单抗,商品名泰圣奇),联合化疗用于一线治疗广泛期的小细胞肺癌。
药物名称:Tecentriq(阿特珠单抗)
生产厂家:罗氏
优先审批时间:2020年2月19日
FDA预计裁定时间:2020年6月19日前
FDA批准时间:2020年5月19日加速获批
适应症:一线单药疗法,治疗PD-L1高表达,且无EGFR或ALK基因突变的晚期非鳞状和鳞状非小细胞肺癌(NSCLC)患者。
获批数据:此次获批是基于3期临床研究IMpower110的结果,该研究显示,在PD-L1高表达患者中,与化疗相比,Tecentriq单药治疗使中位总生存期(OS)延长了7.1个月(20.2个月VS13.1个月;HR=0.595,95% CI:0.398-0.890;p=0.0106)。
乳腺癌新药
05、生存期显著延长!乳腺癌新药图卡替尼震撼上市
2020年4月17日,图卡替尼((Tukysa)提前四个月被FDA加速批准上市了,用于联合曲妥珠单抗和卡培他滨用于治疗局部晚期无法切除或转移性HER2阳性乳腺癌的患者,包括脑转移瘤患者,这些患者已分别或联合接受至少三种先前的HER2指导药物。
与拉帕替尼和neratinib一样,tucatinib是一种口服TKI。然而,tucatinib仅阻断HER2,与其他针对多种受体的药物相比,导致皮疹和腹泻等脱靶效应更少。这种组合有可能成为曲妥珠单抗,帕妥珠单抗和T-DM1治疗后所有HER2阳性乳腺癌患者的新护理标准!
药物名称:tucatinib(图卡替尼)
生产厂家:Genetics
优先审批时间:2020年2月13日
FDA预计裁定时间:2020年8月20日
FDA批准日期:2020年4月17日
适应症:联合曲妥珠单抗和卡培他滨用于治疗局部晚期无法切除或转移性HER2阳性乳腺癌的患者,包括脑转移瘤患者,这些患者已分别或联合接受至少三种先前的HER2指导药物
获批数据:
此次获批是基于一项名为HER2CLIMB II期试验的数据,结果表明,在未经手术切除的局部晚期或转移性HER2阳性乳腺癌患者中,经严格预处理的患者与单独使用曲妥珠单抗和卡培他滨相比,曲妥替尼三联体可使死亡风险降低34%。
曲妥替尼三联药物组合的中位总生存期(OS)为21.9个月,而曲妥珠单抗和卡培他滨单独治疗的中位总生存期(OS)为17.4个月。图卡替尼组和对照组的1年和2年OS发生率分别为76%和62%,45%和27%。
值得注意的是,HER2阳性转移性乳腺癌患者中有一半以上在确诊时已扩散到大脑,图卡替尼具有很好的入脑活性,三联药物将脑转移患者的疾病进展或死亡的风险降低了52%。
副作用:像大多数用于治疗癌症的药物一样,Tukysa可能会引起副作用,其中一些是严重的。
在HER2CLIMB试验中,在接受图卡替尼治疗的人中最常见的副作用是:
腹泻;手足综合症;恶心;疲劳;呕吐。
图卡替尼的价格:
目前该药物在美国的标价为18,500美元30天,每位患者一个疗程的平均治疗费用为111,000美元。我们期待这款药物能早日在国内获批,纳入医保,给更多经过多线治疗的晚期患者新的治疗方案。
06、全球首款三阴乳腺癌抗体偶联药物Trodelvy来袭
ADC药物家族在2020年4月22日又新添了一名“冉冉的新星”!Immunomedics公司宣布,美国FDA已加速批准其抗体偶联药物Trodelvy(sacituzumab govitecan-hziy)上市,用于治疗既往接受过至少2种疗法的转移性三阴乳腺癌(mTNBC)成人患者,批准时间比预定的6月2日审批日期提前了一个半月!大家可能会觉得很陌生,其实它就是大名鼎鼎的IMMU-132,我们之前多次写到过这款药物。
这意味着,Trodelvy是FDA批准的首个治疗三阴乳腺癌的抗体偶联药物,也是全球首个获批的靶向人滋养层细胞表面抗原2(Trop-2)的抗体偶联药物。
药物名称:Trodelvy(sacituzumab govitecan-hziy,IMMU-132)
生产厂家:Immunomedics公司
FDA批准时间:2020年4月22日
适应症:
既往接受过至少2种疗法的转移性三阴乳腺癌(mTNBC)成人患者。
获批数据:
Trodelvy单药治疗整体缓解率为33.3%,其中完全缓解率2.8%和部分缓解率30.6%,远高于传统化疗组的疗效。37%的患者疗效评价为疾病稳定,仅有25.9%的患者出现了疾病进展。 临床获益率高达45.4%,包含疾病稳定超过6个月的患者。
作用靶点:
Trodelvy由两部分组成:靶向药部分Trop-2抗体和化疗药部分SN-38(类似于伊立替康)。与其他的ADC药物一样,Trop-2抗体部分可以特异地结合到肿瘤细胞表面,比如乳腺癌、肠癌和肺癌细胞;而SN-38可以轻松毒死癌细胞。
从作用机理来看,TROP-2在多种肿瘤细胞(如:乳腺癌、宫颈癌、结直肠癌、肾癌、肝癌、肺癌、胰腺癌、前列腺癌等)中均大量表达。理论上,该药对各种实体肿瘤均有治疗潜力。
胃肠间质瘤新药
07、死亡风险降低85%,胃肠间质瘤新药ripretinib上市
就在2020年5月15日,美国FDA宣布,批准蛋白激酶抑制剂Qinlock(ripretinib,瑞普替尼)片剂上市,成为首款专门4线治疗晚期胃肠道间质瘤(GIST)的创新疗法。此药的适应症为GIST成年患者,他们已经接受过3种以上蛋白激酶抑制剂疗法,其中包括伊马替尼(imatinib)。
药物名称:ripretinib(瑞普替尼 DCC-2618)
生产厂家:Deciphera Pharmaceuticals
优先审批时间:2020年2月13日
FDA预计裁定时间:2020年8月13日
获批时间:2020年5月15日加速获批
适应症:晚期胃肠道间质瘤(GIST)患者
获批数据:
此次批准主要是基于INVICTUS III期临床研究数据。最后研究结果显示,Ripretinib能够改善四线及四线以上GIST患者的无进展生存期,耐受性总体较好。
无进展生存期(PFS):与安慰剂相比,接受Ripretinib治疗的患者疾病进展或死亡风险降低了85%,mPFS为6.3个月,而安慰剂组为1.0个月。
总生存期(OS):与安慰剂相比,接受Ripretinib治疗的患者死亡风险降低了64%,mOS为15.1个月,而安慰剂组为6.6个月。
作用靶点:
目前,高达85%的GIST肿瘤在血小板衍生生长因子受体α(PDGFRα)和KIT这两个基因突变之一。最常见的为KIT激酶约占75%~80%,其次是PDGFRα约占5%~10%。
这些突变导致异常KIT和PDGFRA蛋白的产生,从而驱动癌症。这两种蛋白质通常可以通过伊马替尼和类似的药物来关闭,这些药物会阻止蛋白质的活性。
Ripretinib选择性结合PDGFRA和KIT蛋白,在实验室研究中,该药物可与所有测试的突变PDGFRA蛋白结合并抑制其在癌细胞中的活性。
胆管癌新药
08、全球首个胆管癌靶向药pemigatinib闪亮登场
2020年4月17日,胆管癌患者迎来了一个重磅好消息!FDA加速批准Incyte公司Pemazyre(pemigatinib),用于治疗既往接受过治疗的携带成纤维细胞生长因子受体2(FGFR2)融合或重排的局部晚期或转移性胆管癌患者,批准时间比预定的5月30日审批日期提前了一个半月,这也是FDA批准的首个胆管癌靶向疗法。
此药二线治疗胆管癌患者的无进展生存率ORR达35.5%,疾病控制率DCR为82%,成为胆管癌历史上第一个靶向药物!具有划时代的意义!
药物名称:Pemazyre(pemigatinib)
生产厂家:Incyte公司
FDA预计裁定时间:2020年5月30日
获批时间:2020年4月17日加速获批
适应症:既往接受过治疗的携带成纤维细胞生长因子受体2(FGFR2)融合或重排的局部晚期或转移性胆管癌患者
获批数据:
146例经过≥1线治疗的晚期胆管癌患者,分为3个队列:A是FGFR2融合/重排(107例),B是其他FGFR突变(20例),C是非FGFR突变(18例),1例患者未定。所有患者均接受Pemigatinib治疗(13.5mg,每天1次,用2周歇1周)。
结果显示,A组客观缓解率(ORR)为35.5%,其中3例(2.8%)患者完全缓解(CR),35例(32.7%)患者部分缓解(PR),50例(46.7%)患者疾病稳定,疾病控制率为82%。B组和C组的ORR为0%。相比其他两个队列,队列A的患者对药物有效响应的比例大很多,有效时间也长得多。
作用靶点:
FGF/FGFR通路的异常激活可以使肿瘤细胞以“自给自足”的方式维持生长,所以FGFRs成为肿瘤治疗的新靶点。临床数据显示,胆道癌中有13%~20%的患者携带FGFR2融合。因此,胆管癌患者若想要采用pemigatinib治疗首先需要确定是否携带FGFR2基因突变,想要进行基因检测的癌友们详情可以咨询全球肿瘤医生网医学部,若是做过基因检测的癌友可以将检测报告提交给医学部进行病情评估。
FDA在同一天批准FoundationOne CDx作为唯一用于pemigatinib的伴随诊断。而实际上,FoundationOne CDx是Foundation Medicine开发的全面基因组分析检测方法,被批准作为多种癌症的辅助诊断工具,可用于总共20种不同的治疗方法。

前列腺癌新药
09、前列腺癌也有BRCA突变!靶向药鲁卡帕利获批上市
2020年5月15日,Clovis Oncology公司宣布,美国FDA加速批准其PARP抑制剂Rubraca(rucaparib,鲁卡帕利)片剂扩展适应症,用于治疗携带有害BRCA基因突变的转移性去势抵抗性前列腺癌(mCRPC)成人患者,这些患者已经接受了雄激素受体靶向疗法和紫杉烷类化疗。这是首款获批治疗前列腺癌的PARP抑制剂。
药物名称:Rubraca(rucaparib,鲁卡帕利)
生产厂家:Clovis Oncology公司
获批时间:2020年5月15日加速获批
适应症:携带有害BRCA基因突变的转移性去势抵抗性前列腺癌(mCRPC)成人患者,这些患者已经接受了雄激素受体靶向疗法和紫杉烷类化疗
获批数据:
这项研究基于TRITON2试验,盲法独立放射学审查(IRR)结果显示,在携带有害BRCA突变的可评估患者中:
确认的ORR为44%;在携带生殖系BRCA突变和体细胞BRCA突变的患者中,观察到的ORR相似。
在数据截止时,中位持续缓解时间(DOR)不可评估(范围:1.7~24.0+个月)。在27例(56%)病情实现客观缓解的患者中,有15例DOR≥6个月。
作用靶点:
Rubraca的活性药物成分为rucaparib,这是一种口服、小分子的多聚ADP核糖聚合酶(PARP)抑制剂,可靶向抑制PARP1、PARP2、PARP3。rucaparib可利用DNA修复途径的缺陷,优先杀死癌细胞,这种作用模式赋予了该药治疗存在DNA修复缺陷的广泛类型肿瘤的潜力。PARP与广泛的肿瘤类型相关,尤其是乳腺癌和卵巢癌。
目前这些新药还未在内地获批上市,而我国香港地区在新药引进方面是与国际同步的,国际最新治疗方案可以在香港同步实施。
上一篇:独居的我,阳了
下一篇:多地官宣:无症状和轻症可上班
最近更新热点资讯
- 谷歌AI聊天记录让网友San值狂掉:研究员走火入魔认为它已具备人格,被罚带薪休假
- 豆瓣9.4,姐弟恋、三人行,这部大尺度太厉害
- Genes, Intelligence, Racial Hygiene, Gen
- 【土耳其电影】《冬眠》电影评价: 宛如一部回归伯格曼风格的道德剧
- 陌生人社会伦理问题研究
- 理论研究|前海实践的价值理性和工具理性
- 澳门刑事证据禁止规则
- 综艺普及剧本杀和密室逃脱助力线下实体店爆发式增长
- 日本小伙和五个小姐姐同居?看完我酸了!
- 第一学期高一语文考试期中试卷
- 高中必考的物理公式有哪些
- 这部大尺度的申奥片,却讲述了不lun恋...
- 心理语言学论文精品(七篇)
- 《贵妃还乡》 超清
- 专论 | 郭丹彤、陈嘉琪:古代埃及书信中的玛阿特观念
- 微专业招生 | 数字文化传播微专业列车即将发车,沿途课程抢先看!
- 生态安全的重要性汇总十篇
- 原创因“18禁”电影登舆论顶峰,万千少女一场春梦:这一生,足够了
- 章鱼头
- 读书心得体会
- 考研考北京大学医学部或者协和是一种怎样的难度?
- 央媒评女主播编造“夜宿故宫”:让肇事者付出代价,理所应当
- 库欣病患者求医记(流水账)
- 《太平公主》④ | 地位越高,越要装傻
- 爱体检 安卓版 v2.5
