 手机访问:wap.265xx.com
手机访问:wap.265xx.com帕博利珠单抗联合铂类化疗对非小细胞肺癌和稳定型脑转移患者的疗效:基于021、18
摘 要
简介:这项探索性分析回顾性评估了晚期非小细胞肺癌患者的预后,以确定基线脑转移是否影响一线帕博利珠单抗联合化疗与单独化疗的疗效。患者和方法:我们汇集了KETNOTE-021队列G(非鳞状)、KETNOTE-189(非鳞状)和KETNOTE-407(鳞状)晚期NSCLC患者的数据。患者被分配到铂双联化疗中,加或不加35个周期的帕博利珠单抗,每3周200毫克。所有研究都允许登记那些先前接受治疗或未接受治疗(仅限于KETNOTE-189/KETNOTE-407)稳定脑转移的患者。接受过脑转移治疗的患者临床上稳定了2周(KETNOTE-021队列中的G≥4周),没有新的或扩大的脑转移的证据,并且在服药≥3天前没有使用类固醇药物。已知未治疗的无症状性脑转移瘤的患者需要定期进行脑部成像。
结果:共纳入1298例患者,其中171例有脑转移灶,1127例无脑转移灶。数据截止点的中位(范围)随访时间分别为10.9(0.1-35.1)个月和11.0(0.1-34.9)个月。有脑转移和无脑转移患者的总生存率(0.48[95%CI,0.32~0.70]和0.63[95%CI,0.53~0.75])和无进展生存率(0.44[95%CI,0.31~0.62]和0.55[95%CI,0.48~0.63])风险比(Pembrolizumab加化疗/化疗)相似。在脑转移患者中,帕博利珠单抗联合化疗的中位总生存期为18.8个月,化疗的中位总生存期为7.6个月,中位无进展生存期分别为6.9个月和4.1个月。目的无论脑转移情况如何,帕博利珠单抗联合化疗与化疗相比,有效率更高,持续时间更长。在35例脑转移瘤患者中,帕博利珠单抗联合化疗与化疗相比,与化疗相关的不良事件发生率分别为88.2%和82.8%,无脑转移患者的94.5%和90.6%,差异有统计学意义(P<0.05)。在脑转移瘤患者中,与化疗相关的不良事件发生率分别为88.2%和82.8%,无脑转移瘤患者中与化疗相关不良事件发生率分别为94.5%和90.6%。
结论:无论有无脑转移,帕博利珠单抗联合铂类组织学特异性化疗在所有PD-L1亚组(包括PD-L1肿瘤比例评分<1%的患者)中都比单独化疗改善了临床结果,并且在晚期非小细胞肺癌患者中具有可控的安全性。该方案是治疗晚期非小细胞肺癌幼稚患者的标准治疗方案,包括稳定性脑转移患者。
前言
大约三分之一的晚期非小细胞肺癌(NSCLC)患者发生脑转移。历史上诊断为脑转移的NSCLC患者的预后很差,中位总生存期(OS)估计为7.8个月,不管患者是否有脑转移。虽然这些患者的预后很差,但他们很少参加临床试验,导致这一组的有效性和安全性数据很少。系统治疗已被证明与。和一些临床试验已经探索了检查点抑制剂免疫治疗与化疗前或化疗后联合使用或给药的协同效应。
在KETNOTE-021的队列G中,抗程序性死亡1(PD-1)单克隆抗体pembrolizumab加基于铂的化疗的一线治疗显示,与仅以铂为基础的化疗相比,Pembrolizumab提高了疗效,并且在非鳞状NSCLC(第2期KETNOTE-021[队列G],第3期KETNOTE-189)8,9和鳞状NSCLC(第3期KETNOTE-407).10中,客观缓解率的主要终点(。独立的中心综述显示,培布罗利珠单抗联合化疗的患者占55%,而单独接受化疗的患者占29%(P=0.0016)。KETNOTE-189和KETNOTE-407的OS和无进展生存期(PFS)在联合治疗后均有明显改善。在这两项研究中,死亡的危险性比(HRs)分别为0.49(95%CI,0.380.64)和0.64(95%CI,0.490.85);疾病进展和死亡的危险性比(HRs)分别为0.52(95%CI,0.430.64)和0.56(95%CI,0.450.70)(均P<0.001)。
KEYNOTE-021队列G、KEYNOTE-189和KEYNOTE-407分别登记了化疗未治疗的晚期非小细胞肺癌患者,并允许登记脑转移患者,前提是患者临床稳定。这项探索性分析是为了更好地描述这一历史上预后较差的人群的结果。我们汇集了这三项临床试验中的个体患者数据,以回顾性评估帕博利珠单抗加铂类化疗与单独化疗在基线水平有或无稳定脑转移的患者中的效果。
方法
病人准备
来自三项研究的患者,KETNOTE-021队列G(NCT02039674),KETNOTE-189(NCT02578680),和KETNOTE-407(NCT02775435),10例纳入了这项特别后合并分析。每项研究的方法都已在前面描述过,并在此简要总结。研究方案得到了机构审查委员会/伦理委员会的批准,研究是根据良好临床实践指南进行的。所有患者均提供书面知情同意书。
在所有三项研究中,符合条件的患者年龄均为18岁,经病理证实无表皮生长因子受体或碱性磷酸酶改变的非鳞状非小细胞肺癌(KEYNOTE-021G和KEYNOTE-189)或鳞状非小细胞肺癌(KEYNOTE-407),RECIST1.1版定义的≥1可测量病变,以及东部合作肿瘤学小组的表现状态为0或1。KEYNOTE-189和KEYNOTE-407的患者有IV期(即,转移性)疾病;所有患者都被要求提供肿瘤样本以确定程序性死亡配体1(PD-L1)状态,并且以前不能接受晚期疾病的系统治疗。在每项研究中,所有患者都需要基线中枢神经系统(CNS)显像。那些曾接受治疗的脑转移患者临床稳定2周(KETNOTE-021G组中为≥4周),且在研究治疗开始前3天未接受过类固醇治疗,符合登记资格;无症状脑转移患者(即无神经系统症状、不需要皮质类固醇和病灶≤1.5厘米)有资格参加KETNOTE-189和KETNOTE-407,但需要定期进行大脑成像,将其作为发病部位。
研究设计与治疗
KETNOTE-021队列G患者随机给予帕博利珠单抗200 mg加培美曲塞500 mg/m2,卡铂曲线下面积(AUC)5 mg/mL/min,每3周4个周期,随后培美曲塞500 mg/m2加卡铂5 mg/mL/min,疗程24个月。每支手臂允许选择性无限期培美曲塞维持治疗。在KETNOTE-189试验中,患者被随机分为4个周期,分别接受培美曲塞500 mg/m2和铂类药物(顺铂75 mg/m2或卡铂AUC 5 mg/mL/min)加培溴利珠单抗200 mg或安慰剂,每3周一次,然后再接受培美曲塞单抗或安慰剂共35个周期,外加无限期培美曲塞维持治疗。KETNOTE-407中的患者被随机分成1:1,在第一天接受200毫克的培溴利珠单抗或安慰剂治疗,共35个三周周期;在前四个周期中,所有患者在第一天接受卡铂(AuC6 mg/mL/min)治疗,在第一天接受紫杉醇(200 mg/m2)治疗,在第一天、第8天和第15天接受NaB-紫杉醇(100 mg/m2)治疗。随机分组按照主要文献中的描述进行分层;在所有研究中。
评估
在KETNOTE-021队列G和KETNOTE-407中,放射成像与计算机断层扫描或磁共振成像在基线上进行,前18周每6周进行一次,然后每9周进行一次至45周(KETNOTE-407)或一年结束(KETNOTE-021队列G),此后每12周进行一次应答评估。在KETNOTE-189中,在基线、第6周和第12周进行成像,然后每9周到48周进行一次成像,之后每12周进行一次成像。所有研究都需要基线中枢神经系统显像;对于无症状性脑转移瘤患者,随后的中枢神经系统成像在每次反应评估时都需要,对于接受治疗的脑转移瘤患者,则由研究者自行决定。在整个KETNOTE肺部计划一致的成像章程中,所有的脑损伤都将被归类为非靶病变,即使它们是可测量的。根据RECIST 1.1版,通过盲法、独立的中心评议评估肿瘤反应。在研究治疗期间和治疗后30天监测15个不良事件(AE),并根据国家癌症研究所不良事件通用术语标准(版本4.0为KETNOTE-021队列G和KETNOTE-189;版本4.03为KETNOTE-407)进行分级。治疗后监测严重不良反应90天。使用PD-L1IHC 22C3药物Dx试验(Agilent Technologies,Carpinteria,CA,USA)在诊断转移疾病时收集的福尔马林固定肿瘤标本中,由中心实验室确定PD-L1的表达状态。
研究终点
在这项综合分析中评估的终点是OS、PFS、ORR、应答持续时间(DOR)和不良反应发生率。OS定义为从随机化到死于任何原因的时间。根据RECIST版本1.1的定义,PFS被定义为从随机化到疾病进展或死于任何原因的时间。ORR定义为放射学证实完全或部分有效的患者所占比例。对于完全或部分应答的患者,DOR被定义为从第一次记录的应答证据到疾病进展的时间。
统计分析
这三项研究的意向治疗(ITT)人群的个体患者数据被包括在这项合并分析中。
疗效在合并的ITT人群中进行评估;安全性在接受≥1剂量研究治疗的合并人群中进行评估。所有的分析都是描述性的,不受多样性的控制。使用Kaplan-Meier方法估计OS、PFS和DOR。对于OS和PFS,HRs和95%的治疗差异是基于以治疗为协变量的Cox比例风险回归模型。
结果
病人处理
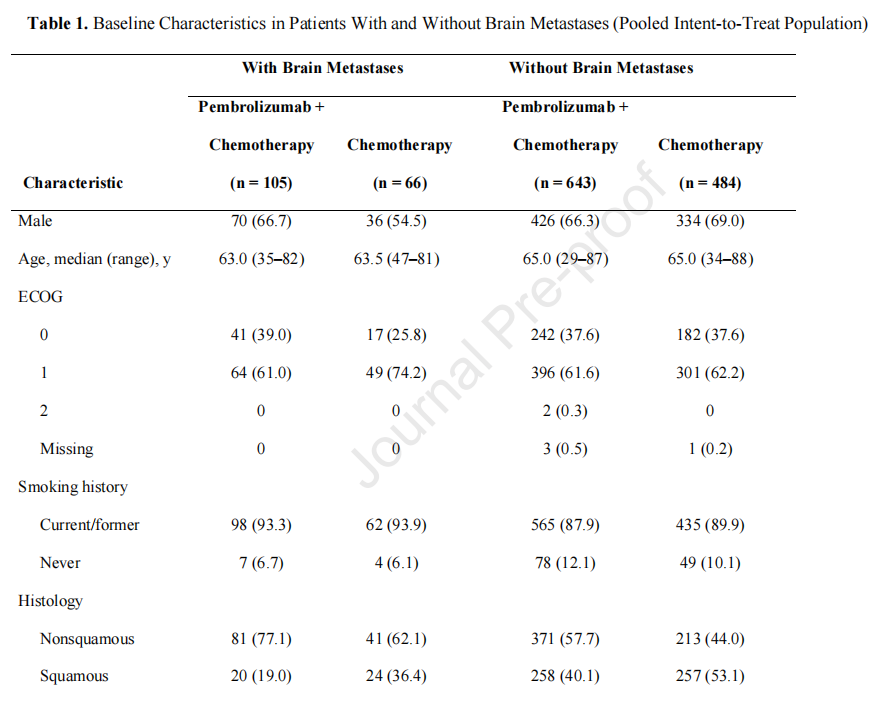
这项综合分析共纳入1298名患者;171名(13.2%)在基线时有脑转移,1127名(86.8%)没有脑转移。在基线脑转移患者中,105人被分配接受培溴利珠单抗加化疗,66人被分配为单独接受化疗。在没有基线脑转移的患者中,643名和484名患者分别被分配到培溴利珠单抗加化疗或化疗(图1)。KETNOTE-021队列G的数据截止日期为2017年12月1日;KETNOTE-189的数据截止日期为2018年9月21日;KETNOTE-407的数据截止日期为2018年4月3日。有脑转移患者和无脑转移患者的中位随访时间分别为10.9(0.1~35.1)个月和11.0(0.1~34.9)个月。
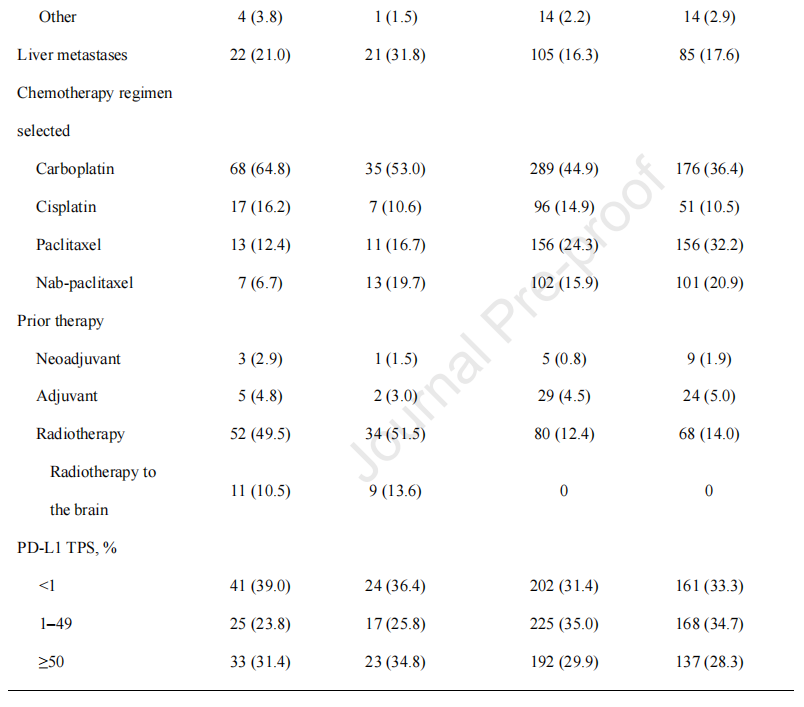
基线特征在有和没有基线脑转移的患者之间大体相似(表1)。脑转移组中非鳞状组织学(71.3%比51.8%)、使用卡铂(60.2%比41.3%)、既往接受放射治疗(50.3%比13.1%)和肝转移(25.1%比16.9%)的患者比例较高。在脑转移患者中,有20例在放疗前接受过脑放疗(培溴利珠单抗加化疗,n=11;单纯化疗,n=9)。PD-L1亚组患者(<1%,1%49%,≥50%)在有脑转移和无脑转移的患者中所占比例相似。
总体生存
在数据截止时,在基线脑转移患者中,帕博利珠单抗加化疗组105名患者中有56名(53.3%)死亡,而化疗组66名患者中有49名(74.2%)死亡。在没有基线脑转移的患者中,培溴利珠单抗加化疗组643人中有264人(41.1%)死亡,化疗组484人中有250人(51.7%)死亡。如图2A和2B所示,在脑转移患者中,培溴利珠单抗联合化疗与化疗相比,中位OS延长(18.8[95%CI,13.825.9]vs 7.6个月[95%CI,5.410.9];死亡HR,0.48[95%CI,0.320.70])和无脑转移患者(22.5[95%CI,19.825.2]vs 13.5个月[95%CI,11.315,8];死亡HR为0.6 3[95%CI,0.5 30.75]。
在所有PD-L1亚组中都可以看到帕博利珠单抗联合化疗与化疗相比在所有PD-L1亚组中的益处(图2C)。
无进展生存
截止数据时,在基线脑转移患者中,帕博利珠单抗加化疗组105名患者中有82名(78.1%)和化疗组66名患者中有62名(93.9%)病情恶化或死亡。在没有基线脑转移的患者中,帕博利珠单抗加化疗组643人中有402人(62.5%)和化疗组484人中有368人(76.0%)病情恶化或死亡。如图3A和图3B所示,接受帕博利珠单抗联合化疗的脑转移患者的中位无症状生存时间(6.9[95%CI,5.78.9]vs 4.1个月[95%CI,2.34.6];无脑转移患者的HR[0.44[95%CI,0.310.6 2])和无脑转移患者(8.8[95%CI,8.19.5]vs 5.3个月[95%CI,4.86.1];PFS的HR为0.55[95%CI,0.480.63]。
Pembrolizumab加化疗与化疗相比,在所有PD-L1亚组中都有好处(图3C)。
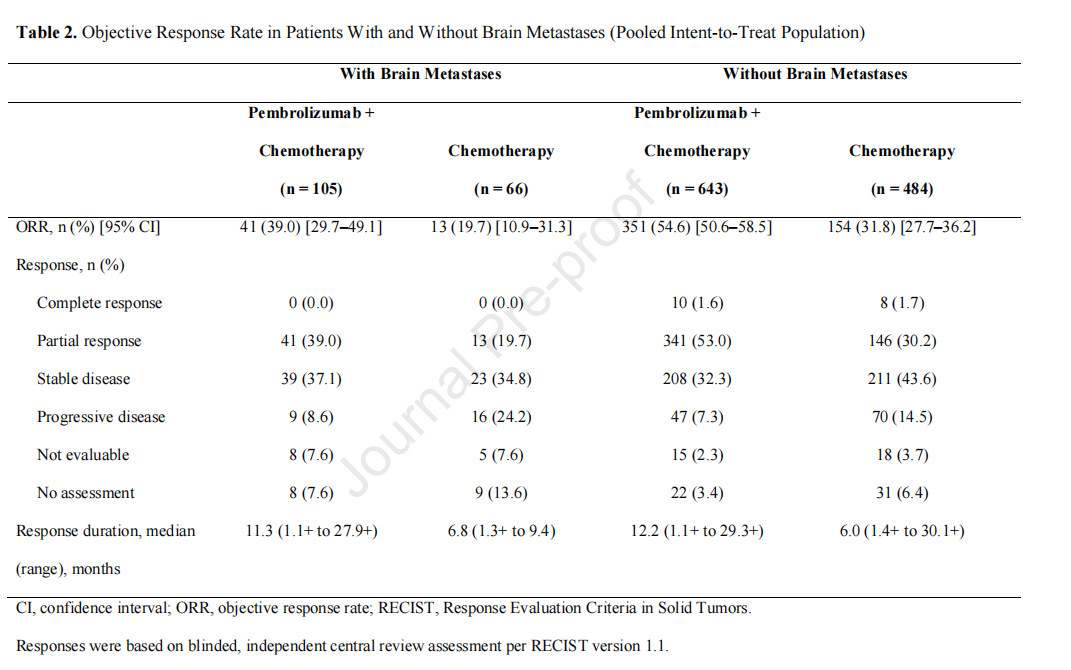
客观应答率
在有或没有基线脑转移的患者中,在化疗的基础上加用帕博利珠单抗与单独化疗相比可以改善ORR(表2)。在脑转移患者中,帕博利珠单抗联合化疗的ORR为39.0%,化疗的ORR为19.7%。在无脑转移的患者中,帕博利珠单抗联合化疗的ORR为54.6%,化疗的ORR为31.8%。值得注意的是,根据RECIST 1.1版,这些是系统性反应;没有收集中枢神经系统反应。
在脑转移患者中,帕博利珠单抗联合化疗组和化疗组的中位(范围)DOR分别为11.3(1.1+~27.9+)个月和6.8(1.3+~9.4)个月。在无脑转移的患者中,帕博利珠单抗联合化疗组和化疗组的中位(范围)DOR分别为12.2(1.1+~29.3+)个月和6.0(1.4+~30.1+)个月。
安全性
基线脑转移患者接受帕博利珠单抗联合化疗和单纯化疗的中位(范围)治疗时间分别为7.0(0.03~29.1)个月和4.2(0.03~18.5)个月。在这一人群中,联合治疗组102名患者中的90名(88.2%)和化疗组64名患者中的53名(82.8%)发生了任何级别的与治疗相关的不良反应(表3)。61例(59.8%)发生≥-3级治疗相关不良反应,29例(45.3%)发生AEs。与治疗相关的不良反应导致联合治疗组26例(25.5%)和化疗组7例(10.9%)停止研究治疗,分别有6例(5.9%)和1例(1.6%)死于治疗相关的不良反应。联合治疗组有33例(32.4%)≥-1治疗相关的AE影响神经系统,而化疗组有11例(17.2%);最常见的不良反应如表3所示。在联合治疗和化疗组中,免疫介导的事件分别发生在26名(25.5%)和6名(9.4%)患者中,而不考虑与研究治疗的关系。
无基线脑转移患者的安全性结果(表3)与总体研究人群一致。接受帕博利珠单抗联合化疗或化疗的无脑转移患者的中位(范围)治疗时间分别为6.9(0.03~30.4)个月和4.3(0.03~30.7)个月。
在联合治疗组中,有脑转移的患者与无脑转移的患者相比,死于与治疗相关的不良反应的比例更高(n=6[5.9%]比n=13[2.0%]);在这19例死亡中,只有1例被归因于神经事件(脑转移患者的脑病)。
讨论
患有脑转移的非小细胞肺癌患者的预后通常很差,而且这些患者在临床试验中的代表性往往很低。3-7,16事实上,在这项来自三个随机对照试验的患者的汇集分析中,无论采用哪种治疗组,基线状态下有稳定脑转移的NSCLC患者与未治疗或未治疗的患者相比,预后更差。在晚期非小细胞肺癌患者中,帕博利珠单抗加铂为基础的化疗与单独化疗相比,无论是否存在基线脑转移,都显示出显著的临床结果改善。在脑转移患者中,培溴利珠单抗联合化疗降低了死亡风险(OS的HR为0.48)和进展或死亡的HR(PFS的HR为0.44)。接受帕博利珠单抗联合化疗的脑转移瘤患者的中位OS明显长于接受化疗的患者,尽管这组患者的预后较差(18.8个月比7.6个月)。在所有分析的终点(即OS、PFS、ORR、DOR)和所有3个PD-L1TPS亚组(<1%、1%-49%、≥50%)中,联合治疗对基线脑转移患者都有好处。帕博利珠单抗联合化疗在有和没有基线脑转移的患者中具有可控的安全性。
虽然放射治疗一直是非小细胞肺癌脑转移患者的主要治疗手段,但越来越多的证据表明,作为单一药物进行免疫治疗具有临床益处。7,17-19最近的一项第二阶段研究表明,帕博利珠单抗治疗对未经治疗的脑转移患者有效,PD-L1表达≥为1%,脑转移有效率为29.7%(95%CI,15.9%-47.0%)。17临床研究中有关使用帕博利珠单抗的数据有限。
我们不知道有任何其他PD-1或PD-L1抑制剂在这一人群中与化疗相结合的文献,尽管一项正在进行的2期研究正在评估阿替唑珠单抗加卡铂/培美曲塞在非小细胞肺癌患者和未经治疗的无症状脑转移患者中的作用(NCT03526900)。最近在晚期NSCLC患者中进行的尼伏单抗加ipilimumab与单独化疗的3期临床试验发现,在基线上有无症状的中枢神经系统转移患者(n=81)和未经治疗的患者(n=712),OS倾向于联合治疗。此外,我们的结果与一项真实世界研究的结果一致,该研究评估了帕博利珠单抗加卡铂和培美曲塞治疗有脑转移和无脑转移的晚期非鳞状NSCLC患者,并显示出活性。
在我们的综合分析中没有发现新的安全信号。Pembrolizumab加化疗在有和没有基线脑转移的患者中的安全性相似,脑转移的存在不会增加影响神经系统的与治疗相关的不良反应的发生率。联合治疗组与化疗组相比,与治疗相关的不良反应(包括那些导致研究中断的不良反应)的发生率更高。联合治疗组较长的治疗时间可能是导致这一结果的原因之一。
我们的结果可与类似患者群体中培溴利珠单抗治疗与化疗的单独分析结果相比较并加以扩展。在这项分析中,我们汇集了四个临床试验(基调-001、010、024和042)的数据,以回顾性评估PD-L1阳性非小细胞肺癌患者和以前治疗过的稳定脑转移患者的结果。
帕博利珠单抗治疗改善了临床结果,在该队列中与化疗相比耐受性良好,同时在有脑转移和无脑转移的患者中提供了类似的益处。
我们的汇集分析是探索性的,没有对多样性进行调整;因此,对结果的解释必须谨慎。然而,将三个临床试验的患者数据汇集在一起,从而增加了纳入的患者数量,可以比分析单个临床试验的结果更可靠地评估结果。另一个限制是,我们的分析是回顾性的,尽管三项临床试验中的两项(KETNOTE-189和KETNOTE-407)规定脑转移患者将成为探索性分析的对象。低比例的患者之前接受过脑放疗,这表明大多数患者有无症状的小脑转移。这限制了结果对普通非小细胞肺癌患者的翻译。不幸的是,在我们的合并分析中无法评估颅内反应,因为在这些研究中脑部病变被认为是非靶点病变。尽管先前的一些证据表明接受免疫检查点抑制剂治疗的NSCLC患者的颅内反应轻微,包括PD-L1表达的患者接受培溴利珠单抗治疗,但仍需要17项前瞻性研究来评估帕博利珠单抗联合化疗对颅内反应的影响及其与全身反应和OS的关系。破坏血脑屏障和新生血管可能会使化疗渗透到大脑,在临床前研究中,化疗药物已显示出增强肿瘤免疫原性的免疫调节特性。缺乏与疾病进展部位相关的数据是另一个限制。
总而言之,与单纯化疗相比,帕博利珠单抗加铂类化疗改善了存活率和客观反应,而且无论是否存在基线脑转移,其耐受性都是可控制的。Pembrolizumab加基于铂的化疗的联合疗法是治疗初治晚期NSCLC患者的标准治疗选择,包括已治疗和未治疗的稳定脑转移患者。

上一篇:为啥核酸检测阴性结果有效期限定在7天之内?吴尊友:时限越短越安全
下一篇:国家药监局应急附条件批准河南真实生物科技有限公司阿兹夫定片增加新冠肺炎治疗适应症
最近更新热点资讯
- 谷歌AI聊天记录让网友San值狂掉:研究员走火入魔认为它已具备人格,被罚带薪休假
- 豆瓣9.4,姐弟恋、三人行,这部大尺度太厉害
- Genes, Intelligence, Racial Hygiene, Gen
- 【土耳其电影】《冬眠》电影评价: 宛如一部回归伯格曼风格的道德剧
- 陌生人社会伦理问题研究
- 理论研究|前海实践的价值理性和工具理性
- 澳门刑事证据禁止规则
- 综艺普及剧本杀和密室逃脱助力线下实体店爆发式增长
- 日本小伙和五个小姐姐同居?看完我酸了!
- 第一学期高一语文考试期中试卷
- 高中必考的物理公式有哪些
- 这部大尺度的申奥片,却讲述了不lun恋...
- 心理语言学论文精品(七篇)
- 《贵妃还乡》 超清
- 专论 | 郭丹彤、陈嘉琪:古代埃及书信中的玛阿特观念
- 微专业招生 | 数字文化传播微专业列车即将发车,沿途课程抢先看!
- 生态安全的重要性汇总十篇
- 原创因“18禁”电影登舆论顶峰,万千少女一场春梦:这一生,足够了
- 章鱼头
- 读书心得体会
- 考研考北京大学医学部或者协和是一种怎样的难度?
- 央媒评女主播编造“夜宿故宫”:让肇事者付出代价,理所应当
- 库欣病患者求医记(流水账)
- 《太平公主》④ | 地位越高,越要装傻
- 爱体检 安卓版 v2.5
