 手机访问:wap.265xx.com
手机访问:wap.265xx.com女性如何延缓衰老?
关于女性如何延缓衰老一直广大女性最为关心的问题,希望大家支妙招
肥胖和衰老期间骨髓中脂肪细胞的积累损害了基于干细胞的造血和骨再生
DOI:https://doi.org/10.1016/j.stem.2017.02.009
亮点
?干细胞样群体在骨骼中产生成脂和成骨谱系
?衰老和高脂肪饮食特别促进脂肪生成谱系的扩大
?多能细胞促进和成脂细胞减少造血重建
?成脂细胞抑制骨折修复,通过 DPP4 失活恢复
摘要
衰老和肥胖导致异位脂肪细胞在骨髓腔中积聚。这一过程被认为会损害成骨和造血再生。在这里,我们指定骨的成脂和成骨谱系的细胞特性。当衰老损害成骨谱系时,高脂饮食喂养会激活成脂谱系的扩张,这种效应在老年动物中显著增强。我们进一步描述了具有干细胞样特征的间充质亚群,该亚群产生了血统,同时, 通过促进致命照射后的竞争性再种群,作为造血生态位的主要组成部分。相反,致力于脂肪细胞谱系的骨驻留细胞可能通过产生过量的二肽基 peptidase-4 来抑制造血和骨愈合,二肽基是一种蛋白酶,是糖尿病治疗的目标。这些研究描述了骨驻留脂肪细胞谱系的分子特性,并建立了其参与骨和造血再生的年龄依赖性功能障碍。
图形摘要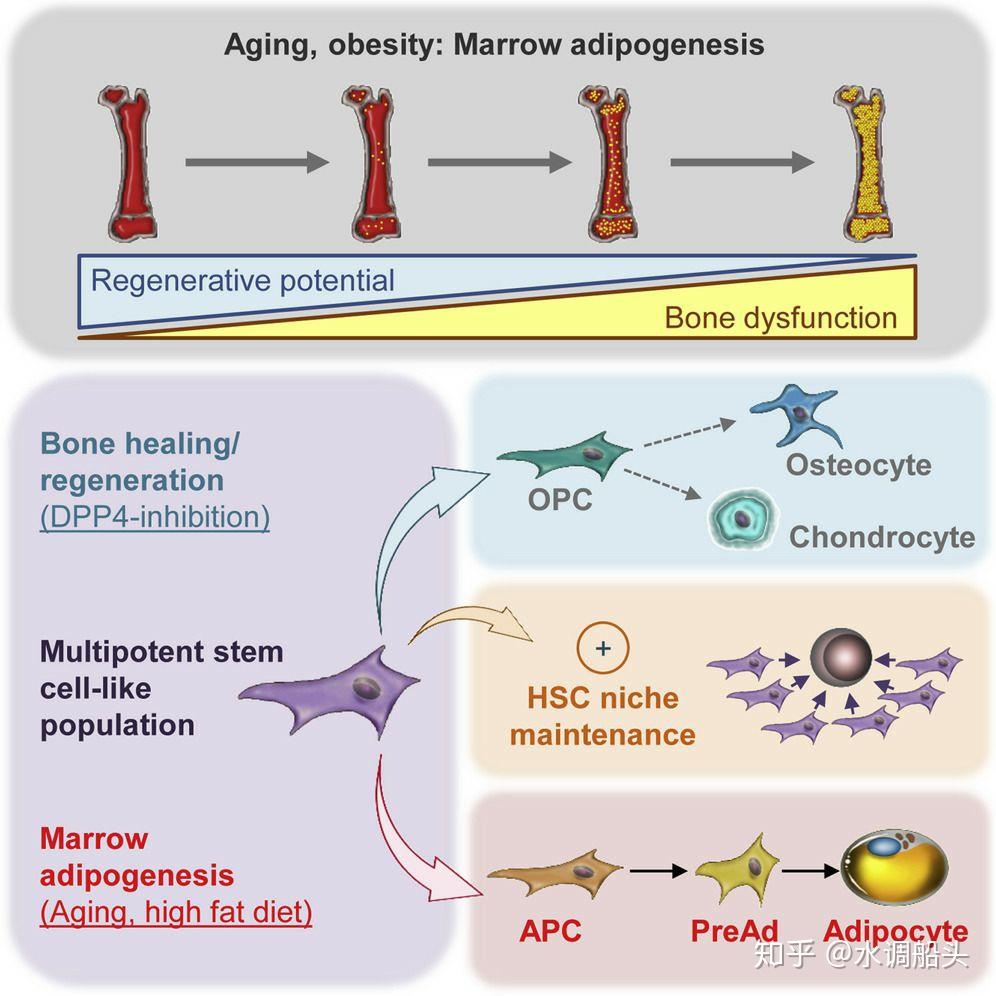

关键词
骨髓脂肪组织 成脂祖细胞 再生
脂肪 DPP4 造血 间充质干细胞
骨愈合 肥胖 老化
介绍
富含脂肪细胞的黄色骨髓在衰老和肥胖期间发展,它可能导致长骨的成骨和造血细胞的功能障碍。根据最近的数据,肥胖个体骨髓脂肪组织 (MAT) 的增加与骨质疏松症和骨折风险增加相关 (法泽利等人。,2013, 施瓦茨,2015)。同样,II 型糖尿病与骨质量下降有关 (卡内维尔等人。,2014)。然而,因果关系还没有完全建立,因为喂食高脂肪饮食的小鼠也显示出垫子的快速增加,而骨骼参数保持不变 (杜塞特等人。,2015)。然而,骨髓脂肪生成与造血功能受损有关 (Naveiras 等人。,2009)。一些看似对立的影响,如衰老和肥胖,但也有热量限制和厌食,放射治疗,噻唑烷二酮类和糖皮质激素,促进 MAT 的积累 (德夫林和罗森,2015)。已经描述了两种类型的垫子: 局部生长板周围的本构垫子 (cMAT) 和调节垫子 (rMAT), 在生命后期积累,并响应高脂肪喂养 (谢勒等人。,2015)。
已经提出,MAT 祖细胞是具有间充质来源的耐辐射非造血细胞 (贝里等人。,2015)。间充质基质细胞 (MSCs) 能够产生成骨细胞、软骨细胞和脂肪细胞 (Fridenshte?n 等人。,1968)。谱系追踪将 MSCs 的发育起源与新生骨髓中的 Osterix1 (Osx1) 表达细胞联系起来 (沟口等人。,2014) 和在成人骨髓中表达瘦素受体 (LepR) 的细胞 (周等人。,2014)。同时,瘦素信号调节成年小鼠的 MAT 形成和成骨 (岳等人。,2016)。骨髓间充质干细胞的亚群,如 C-X-C 基序趋化因子 (CXCL) 12-丰富的网状细胞 (CAR),为造血干细胞龛提供必要的维持信号 (门德尔松和弗雷内特,2014, 莫里森和斯卡登,2014)。
MAT 参与局部成骨和免疫调节过程以及系统代谢强调了进一步研究骨髓间充质细胞成脂潜能的必要性。使用流式细胞术和遗传谱系追踪的组合,我们描述了相当多的细胞异质性,并且我们在雄性小鼠的长骨骨髓腔中识别出不同的间充质细胞亚群。具体来说,我们描述了一个具有干细胞样特性的多能群体,该群体位于血管周围壁龛内,在体外和体内条件下产生了单方面承诺的骨软骨病生和脂肪形成谱系亚群。脂肪细胞显著损害造血再人口和骨折愈合。后一种效果是由分泌的二肽基 peptidase-4 (DPP4) 介导的,这是抗糖尿病治疗的一个重要目标 (Lamers 等人。,2011, Marguet 等人。,2000)。这些发现完全支持 MAT 在骨骼健康和造血中的恶化作用的假设。
结果
骨脂肪细胞谱系的鉴定
为了描绘骨间充质谱系的异质组成,我们使用了脂肪组织和骨中报道的流式细胞术 (森川等人。,2009a, Rodeheffer 等人。,2008, 舒尔茨等人。,2011, 汤等人。,2008)。为此,我们分离了不同的非造血种群 (分化簇 [CD] 45?),非内皮细胞 (CD31?) 通过干细胞抗原 (Sca) 1 的表达可以将细胞细分为培养贴壁成纤维细胞的两个亚群,也表达表面受体血小板衍生生长因子-α (p α; 图 1A 和S1A-S1C)。在体外分化过程中,CD45?CD31?Sca1+细胞表现出高度成脂但有限的骨软骨学潜能。CD45?CD31?Sca1?反过来,细胞是非脂肪生成的,但明显成骨软骨病的 (图 1B)。
图 1骨髓间充质细胞显示功能异质性
显示完整标题
查看大 图像 下载高分辨率 图像
与白色脂肪组织一致 (贝里和罗迪赫弗,2013, Rodeheffer 等人。,2008),我们分离出一群单边承诺的脂肪生成祖细胞,其 CD45?CD31?Sca1+CD24?和一个 CD45?CD31?Sca1+CD24+显示三系分化潜能的群体 (图 1C 和 1D)。在表达 Sca1 和/或 p α 的成纤维细胞中,集落形成单位 (CFU-F) 电位和体外回收率最高,在 CD45 中最高。?CD31?Sca1+Pa+CD24+子集 (人物 S1D 和 S1E)。CFU-F 潜能在成骨 CD45 中富集?CD31?Sca1?Pα+CD45 中不存在的人口?CD31?Sca1?Pα?细胞。成骨 CD45 的分离?CD31?Sca1?Pα+CD24 表达的群体也是可能的,但是这些亚群显示出相同的分化能力 (人物 S1F 和 S1G)。同样,CD45?CD31?Pα?Sca1?细胞主要是 CD24+但是非 CFU-F 的 (人物 S1D 和 S1H)。重要的是,三效 CD45 的两个单独的克隆分析?CD31?Sca1+CD24+群体揭示了多重表型的显著同质性,其中 68 个中的 64 个 (94%) 和 54 个中的 45 个 (83%) 当在存在或没有支持的饲养层细胞培养时,克隆分别能够分化为所有三个谱系 (图 1E 和S1I; 表 S1)。在无喂食器的测定中,均匀性稍低的原因可能是技术差异,例如复制性衰老, 但这也可能意味着这个群体依赖于暴露于来自微环境的营养信号来保持长期的多能性。
转录因子锌指蛋白 (Zfp) 423 标记白色脂肪组织 (WAT) 中的成脂细胞 (古普塔等人。,2012)。令人惊讶的是,但与使用Zfp423-驱动 EGFP 报告应变 (Zfp423-EGFP),Zfp423-EGFP+(Zfp423+) 细胞在 CD45 中作为小于 1% 的小亚群出现?CD31?Sca1?群体,而所有脂肪生成 CD45?CD31?Sca1+细胞是绿色荧光蛋白? (图 S1J)。由于强骨软骨细胞部分的稀释效应,最初可能没有检测到这一小部分成脂细胞 (图 1B)。在文化中,CD45?CD31?Sca1?Zfp423+细胞在分化成脂肪细胞前后保持 GFP 表达 (图 S1K)。相比之下,所有 CD45?CD31?Sca1+细胞仅在分化过程中均匀获得 GFP 表达,该过程与 Sca1 表达的伴随损失相关 (人物 S1K-S1N)。
在Pα-EGFP 报告小鼠、多能细胞和成骨祖细胞在形而上学中与骨干相比更丰富,而成脂祖细胞分布均匀。进一步分析了 p α 、 Sca1 和 CD24 表达到内腔的局限性成骨祖细胞。大多数多能和成脂祖细胞位于骨表面 40 μ m 内的非内酰胺定位中,它揭示了所有非内酰胺 p α 的血管周围关联+直径小于 10 μ m 的血管细胞 (人物 S2A-S2E)。这些发现表明这些功能不同的细胞群的不同微观解剖定位以及血管周围多能和脂肪生成细胞与 L 型血管的优先关联, 而内皮成骨细胞的分布更接近 H 型内皮的定位 (Itkin 等人。,2016, Kusumbe 等人。,2014)。与年轻小鼠骨骼尖端脂肪细胞的优先发生相一致,Zfp423+细胞主要定位于骨的干涸区域,并且它们标记了与血管相关的祖细胞的子集以及骨髓腔的所有成熟脂肪细胞 (人物 S2F-S2H)。
总之,这些发现表明在骨内定义的微观解剖学中至少存在四个不同的细胞群: 具有干细胞样特征的三效血管周围细胞群 (CD45?CD31?Sca1+CD24+),两个功能上和解剖学上不同的祖群,它们命运致力于骨软骨原 (CD45?CD31?Sca1?Pα+) 或脂肪生成 (CD45?CD31?Sca1+CD24?) 血统,以及更成熟的 CD45?CD31?Sca1?Zfp423+脂肪细胞前体阶段。所有四个群体都存在于不同的骨隔间 (表 S2) 和所有 CD45?CD31?Sca1+细胞是成脂的 (图 S2I)。MAT 发生和细胞频率之间没有明显的相关性,我们得出结论,如瘦素等调节信号可能决定成熟脂肪细胞的进展。因为 Sca1+与成熟的 Zfp423 相比,成脂祖细胞的分布也更均匀+细胞 (人物 S2B 和 S2H),这意味着防止脂肪形成成熟的信号可以在年轻小鼠的骨骼中不同地分布。
为了测试体内分化潜能,我们产生了一个携带Zfp423-EGFP 记者,脂联素 (Adipoq)-Cre,以及 Rosa26 位点内的荧光素酶报告,该报告仅在 Cre 介导的重组后表达。G.,在成熟脂肪细胞中 (repAdiLuc, 图 S2J),并且我们产生了第二个带有组成红色荧光 (mTmG 报告等位基因) 的菌株Zfp423-EGFP 记者 (代表TdTom; 图 S2K)。从 rep 分离的所有四个群体的新鲜细胞AdiLuc或代表TdTom通过荧光激活细胞分选 (FACS) (图 S2L) 移植到 B6/白化病小鼠的胸骨区域。8 周后,荧光素酶和 Perilipin 免疫荧光 (IF) 的体内成像显示 CD45 的移植?CD31?Sca1+CD24?和 CD45?CD31?Sca1?Zfp423+成脂群体持续产生真正的成熟脂肪细胞,而体外成骨 CD45?CD31?Sca1?Pα+细胞没有 (图 1F,1G,S3A 和 S3B)。有趣的是,CD45?CD31?Sca1+CD24+细胞产生荧光素酶阳性和阴性的移植 (图 1F)。CD45 荧光素酶阴性组织的 Movat-五次染色?CD31?Sca1+CD24+和 CD45?CD31?Sca1?Pα+细胞显示出骨样骨成骨/矿化结构,但从不显示脂肪细胞 (图 1G 和S3C)。与这一观察一致,四种细胞群的细胞内注射显示只有 CD45?CD31?Sca1+CD24+,CD45?CD31?Sca1+CD24?,和 CD45?CD31?Sca1?Zfp423+细胞,但从不 CD45?CD31?Sca1?Pα+,产生了 Zfp423+内源性微环境中的成脂细胞 (图 S3D)。此外,只有 CD45?CD31?Sca1+CD24+移植能够产生脂肪生成 CD45?CD31?Sca1+CD24?细胞 (图 S3E)。总之,这些发现揭示了 CD45 的多系潜力?CD31?Sca1+CD24+能够产生命运承诺的成脂祖细胞谱系的细胞群 (APCs: CD45?CD31?Sca1+CD24?) 反过来,产生更成熟的前脂肪细胞 (preAd: CD45?CD31?Sca1?Zfp423+) 并且,同时,可以产生一群单边承诺的骨软骨祖细胞 (OPCs: CD45?CD31?Sca1?Pα+),在体外和体内条件下 (表 S3和S4)。
成骨脂肪细胞群来源于间充质、非内皮、非造血谱系
为了确定这四个细胞群体的发育谱系,使用在启动子控制下表达 Cre 重组酶的小鼠菌株进行谱系追踪,以标记造血 (Vav1),内皮 (Cdh5和Tek/Tie2),或间叶 (Prx1和P α)细胞,或成熟脂肪细胞 (Adipoq) 被转移到 mTmG 报告小鼠品系 (贝里和罗迪赫弗,2013, 克鲁格等人。,2014)。IF 和流式细胞术分析揭示了骨髓驻留细胞的非造血、非内皮,但间充质谱系具有纯脂肪生成 (APCs 、脂肪细胞) 或成骨 (骨衬里, 骨细胞) 电位,CD45 也是如此?CD31?Sca1+CD24+具有三系潜能的干细胞样群体 (图 2A-2C)。
图 2MAT 的谱系追踪揭示了间充质、非内皮、非造血谱系
显示完整标题
查看大 图像 下载高分辨率 图像
如之前关于脂肪组织的报告所示,CD45+造血细胞完全由Vav1-Cre,而 CD31+细胞没有追踪到预期的Cdh5-Cre 内皮起源,而是为了Vav1-Cre 造血驱动程序 (图 2D) (贝里和罗迪赫弗,2013)。出乎意料的是,只有 50% 的骨髓脂肪细胞和 CD45?CD31?Sca1+APCs 被标记为Pα-Cre 驱动程序 (图 2),与我们来自P α-EGFP 报告以及 FACS 分析 (图 S3F),但与之前关于该 Cre 菌株不完全重组的报告一致 (克鲁格等人。,2014, 周等人。,2014)。最后,比较中成脂祖细胞的发育谱系Prx1-Cre: mTmG 小鼠显示腹股沟 WAT (iWAT) 和骨骼肌-常驻 CD45 的标记?CD31?Sca1+与骨骼相当的细胞,而棕色脂肪组织 (BAT) 和附睾 WAT (eWAT) 祖细胞几乎没有标记 (图 S3G)。此外,来自骨的体外分化祖细胞的基因表达模式与来自 iWAT 的最相似,具有相似的成脂分化能力和一般成脂基因过氧化物酶体增殖物激活受体的表达γ (Pparg) 和 CCAAT/增强子结合蛋白-α (Cebpa) 和蝙蝠标记解偶联蛋白-1 的缺失或低表达 (Ucp1) 和细胞死亡诱导 DFFA 样效应器 A (Cidea) (人物 S3H-S3M),总之表明骨髓脂肪细胞系与白色而不是棕色脂肪细胞更密切相关。
脂肪细胞谱系对饮食和衰老有反应
接下来,我们检测了年轻 (2 个月) 和老年 (25 个月) 小鼠股骨和胫骨的基因表达。与之前的报告一致 (德夫林和罗森,2015),脂肪生成标记的表达Pparg老骨头增多。然而,CD45 的成脂潜力?CD31?Sca1+从旧骨头中分离出的祖细胞没有改变。相反,成骨标记 Osterix (Osx/Sp7) 表达显著减少,正如 CD45 的成骨能力一样?CD31?Sca1?祖细胞 (人物 S4A-S4C)。接下来,两个年龄的小鼠被喂食高脂肪饮食 24 小时 (1 dHFD) 或 10 天 (10 dHFD)。在 10 dHFD 后,MAT 的积累在老年动物中更明显,而在独立于饮食的老年动物中观察到骨小梁的丢失 (图 3A)。年轻骨骼的 FACS 分析揭示了 CD45 的显著诱导?CD31?Sca1+CD24+1 dHFD 后 APC 频率在 10 只 dHFD 小鼠中不再明显,这表明脂肪细胞祖细胞增殖的快速诱导是短期适应饮食的一种机制 (图 3B 和S4D)。在 25 个月大的小鼠中,相同的 1 dHFD 刺激显著增加多能 CD45?CD31?Sca1+CD24+和 APC 人口分别增加了 3 倍和 2 倍 (图 3B)。
图 3衰老和高脂肪饮食刺激脂肪细胞谱系的扩张
显示完整标题
查看大 图像 下载高分辨率 图像
BrdU 公司在年轻和 15 个月大的时候进行了测试Zfp423-EGFP 小鼠,并在多能 CD45 中显著诱导?CD31?Sca1+CD24+细胞和 APCs,在老年小鼠的 APCs 中效果更明显 (图 3C)。相反,OPC 群体不受 1 dHFD 的影响 (图 3B 和S4E),甚至在 10 dHFD 上显示出频率和增殖率的降低,这种影响仅限于年轻动物 (人物 S4D 和 S4F)。在一个 15 个月大的老年人群体中Zfp423-EGFP 小鼠,Zfp423 的细胞频率+1 dHFD 后,前驱体显著增强,这一效应在幼年动物中显著减弱 (图 3D)。综上所述,这些关于骨驻留祖谱系的发现可以解释在衰老过程中观察到的 MAT 的增强积累以及对饮食线索的响应。
多能细胞和承诺的脂肪细胞对造血重建的显著影响
之前的工作表明 MAT 对造血有负面影响 (Naveiras 等人。,2009)。为了更直接地测试这一点,在剂量的致命照射后 (罗等人。,2015) 在四种细胞群的细胞内移植后进行 (图 4A)。正如辐照后的预期 (谢勒和罗森,2014),5 周后观察到所有组脂肪细胞数量增加,这一效应在命运承诺的 APCs 和 Zfp423 移植后更加明显+PreAds (图 4B)。在完全支持胸骨移植数据的情况下,供体来源 (tdTomato+) 脂肪细胞仅在多能 CD45 时观察到?CD31?Sca1+CD24+细胞、 APCs 或 preAds,但不是 OPCs,被移植 (图 4C)。骨 marrows 的 FACS 分析显示,供体来源的祖细胞在照射/移植后 5 周被保留,表明长期存活 (图 4D,上部面板)。的表达Zfp423除了 OPC 移植后,驱动的 EGFP 很容易在所有 marrows 中被检测到。来自 Zfp423 的所有细胞+前移植保持了 GFP 的表达,表明没有向 GFP 的逆转能力?阶段,而 CD45 的移植?CD31?Sca1+CD24+和 APCs 只是部分 GFP+,表明这些细胞保持了它们最初的身份,但也导致了成熟的 Zfp423+PreAds (图 4D,中间面板)。与我们最初的特征一致,Zfp423+细胞不再表达 Sca1 或 CD24 (图 4D,下面板)。
图 4祖群在造血恢复中的不同作用
显示完整标题
查看大 图像 下载高分辨率 图像
在分析前 5 周接受过成脂移植 (APCs 或 preAds) 的 Tibiae 显示细胞数量显著减少,但整体骨髓嵌合性没有变化 (图 4E 和 4F)。在对侧 tibiae 和供体来源的髓细胞和淋巴细胞、血液嵌合或脾造血祖细胞中没有观察到这些参数的任何差异, 因为这些后一种细胞也可能来源于其他未注射的骨部位 (图 4E 、 4F 和S5A-S5D)。重要的是,造血谱系频率 (林)?Sca1+C-套件+造血祖细胞 (LSK 细胞) 和与供体来源的再分配 (cd45。1+) CD34?长期 (LT)-LSK 和 CD34+脂肪转化移植后,短期 (ST)-LSK 细胞显著减少 (图 4G-4I)。在照射后 16 周的单独长期重建实验中,移植 APCs 后观察到造血重建受损的类似趋势,但没有达到统计学意义 (人物 S5E-S5G)。在长期重建过程中,在移植了 APCs 的动物中没有观察到血液嵌合或血液淋巴或血液髓细胞的差异 (人物 S5H-S5J)。FACS 分析显示移植细胞被保留,并证实只有 CD45?CD31?Sca1+CD24+APCs 产生了 Zfp423+PreAds,尽管频率明显较低 (图 S5K)。
与脂肪细胞相反,多能 CD45 的移植?CD31?Sca1+CD24+在辐射后的 5 周和 16 周,人口导致了 tibiae 中供体来源的 LT-LSKs 和 ST-LSKs 的显著增加,而总体骨髓细胞数量保持不变 (图 4E-4I 和S5E-S5G)。与该人群在造血恢复中的潜在参与一致,其相对频率在照射后短暂升高 (图 S5L)。综上所述,这些分析进一步建立了四个细胞群体之间的发育层次结构,并揭示了 CD45 的潜力?CD31?Sca1+CD24+多能细胞在促脂肪刺激下产生脂肪细胞谱系,同时产生支持造血再生的信号,而脂肪细胞显著减弱重建。
脂肪细胞系抑制骨再生
为了确定脂肪细胞谱系在骨愈合过程中的病理生理作用,从 rep 中分离的所有四个群体TdTom将小鼠移植到稳定的胫骨骨折附近,并在 14 天后进行分析 (图 5A,上面板,S6A 和 S6B)。μ ct 定量显示,与无细胞对照组相比,移植成脂人群后骨折部位的总骨密度 (BMD) 显著降低 (图 5A 、中间面板和5B)。骨折/骨痂部位的组织形态学分析表明,移植成脂群体后,矿化组织的面积减少,软骨组织的数量增加。G.,APCs 和 preAds,与所有其他组相比 (图 5A 、下面板和5C-5E)。由于细胞培养和胸骨移植中显示的谱系限制,这些观察可能表明延迟愈合,因此,软骨结构完全来自脂肪形成移植组中的宿主。除了在内部注射后采用脂肪生成命运 (图 S3D),多能 CD45?CD31?Sca1+CD24+这两个成脂群体产生了一些纤维组织,而只有多能 CD45?CD31?Sca1+CD24+和 OPCs 促成了软骨和成骨结构 (人物 S6C-S6G)。这些观察表明在骨折愈合过程中脂肪细胞的负调节作用,进一步建立了 MAT 在老年骨稳态中的有害作用。
图 5脂肪细胞系抑制骨愈合
显示完整标题
查看大 图像 下载高分辨率 图像
垫子释放的 DPP4 抑制骨愈合
为了确定再生过程的潜在负调节因子,RNA 测序 (RNA-seq) 被用于进一步表征所有四个群体的分子同一性 (人物 S7A 和 S7B)。主成分和层次聚类分析清楚地支持了每个种群的独特性质,为密切相关的 APC 和 preAd 种群的成脂承诺的血统限制提供了第二条证据 (图 6A-6C)。差异表达 (DE) 分析产生了几组已知和潜在的新候选基因来定义每个群体 (图 6D-6G; 表 S5)。例如,标准干细胞标记 (e.G., Nog, Il1rn,和Myc) 富含 CD45?CD31?Sca1+CD24+多能干细胞群 (图 6D)。此外,已知的调节造血干细胞 (HSC) 静止和维持的信号 (e.G., Cxcl12, Kitl/Scf,和Vcam-1),在这个群体中显示出最高的表达,以及在其他细胞类型中也表达的 LepR 的最高但不是唯一的表达水平。OPC 群体表达了经典的成骨 (e。G., AlpI, Dmp1,和Col1 α/2) 和软骨标记 (e.G., 可以, Col2α1,和Sox9),以及之前描述的骨骼干细胞标记 (Itga5和CD200),在更高的水平上 (图 6E; 表 S5) (陈等人。,2015)。成脂群体表达了与脂肪细胞谱系相关的高水平标记 (i.E., Cd34, Ebf2,和Dpp4) (阿沃加罗等人。,2014, Rodeheffer 等人。,2008, 王等人。,2014) 或脂肪细胞分化 (i.E., Vim, Ppara; 图 6F 和 6G) (弗兰克等人。,1987, 转托等人。,2011)。不出所料,表达Zfp423在 Zfp423 中最高+PreAds (图 6F)。因此,我们的 RNA-seq 分析证实了这四个群体的细胞特征,并建立了 CD45?CD31?Sca1+CD24+多能干细胞群体作为表达高水平的群体Cxcl12和Lepr是造血干细胞和成骨的重要调节因子 (格林鲍姆等人。,2013, 岳等人。,2016)。
图 6RNA-Seq 定义了骨居民亚群的细胞特性
显示完整标题
查看大 图像 下载高分辨率 图像
为了确定可以调解成脂细胞对骨愈合的负面影响的信号,我们筛选了在成脂群体中显著富集的分泌因子的数据集。调节最显著的分泌因子是二肽基 peptidase-4 的基因编码 (Dpp4),一种从质膜上脱落的蛋白酶,是临床糖尿病治疗的重要目标 (图 7A) (阿沃加罗等人。,2014, Marguet 等人。,2000)。与 RNA-seq 数据一致,CD26 (DPP4 的膜结合形式) 在脂肪细胞群的表面富集,只有 CD45?CD31?Sca1+CD24+和 APCs,但不是 OPCs,在成脂分化后释放 DPP4 到培养基中 (人物 S7C 和 S7D)。的表达Dpp4在含有大多数异位脂肪细胞的老年小鼠的远端 tibiae 中增加,并且老 tibiae 的外植体培养物释放更多数量的 DPP4 (图 7B 和 7C)。同时治疗 CD45?CD31?Sca1+CD24+而带有 DPP4 抑制剂西格列汀的 APCs 对脂肪生成没有影响,它显著增强多能 CD45 的成骨基因表达和矿化?CD31?Sca1+CD24+和成骨分化期间的 OPCs (图 7D,7E,S7E 和 S7F)。虽然在未经治疗的 OPC 移植中没有发现积极作用 (图 5),西格列汀后改善的 OPC 功能可能有助于促进骨愈合。暴露于重组 DPP4 会轻微受损成骨,但不会改变成脂分化 (人物 S7G-S7J)。用两种 DPP4 抑制剂,二普罗丁 A 和西格列汀治疗小鼠,显著加速胫骨骨折愈合 (人物 S7K 和 S7L),和腹腔 (i。P.) 注射西格列汀 9 天显著增加了成骨祖细胞的频率,同时降低了非骨折 tibiae 中 APCs 的频率 (图 7F)。西格列汀的施用足以消除移植脂肪细胞对骨愈合的负面影响,同时令人惊讶地促进 OPC 移植后的骨愈合 (图 7G-7I)。最后,移植Dpp4-缺乏 APCs 类似地阻止了 APCs 对骨折愈合的抑制作用 (图 7J-7L)。
图 7DPP4 抑制逆转成脂细胞对骨再生的负面影响
显示完整标题
查看大 图像 下载高分辨率 图像
讨论
骨髓脂肪生成是一个高度调节的过程,对各种内分泌信号、饮食线索和病理 (谢勒和罗森,2014),反映了高度适应性的干/祖细胞库的必要性。我们的研究建立了多能 CD45 骨髓脂肪细胞谱系的单向发育层次?CD31?Sca1+CD24+干细胞样群体朝向不同的祖细胞群体,具有单边承诺的骨软骨原性或脂肪生成的命运。我们的结果进一步表明,成脂祖细胞不可逆地向前期阶段成熟: 虽然 APCs 可以保持其身份,但它们也会产生 Zfp423+不能恢复到 Sca1 的 preAds+Zfp423?祖先。这种单向过程可以定义两个不同的成熟阶段,随后分化为成熟的 Zfp423+骨髓脂肪细胞。这些发现与最近的研究相一致,这些研究已经详细定义了 WAT 和 BAT 中间质细胞群体的异质性 (贝里和罗迪赫弗,2013, 古普塔等人。,2012, Rodeheffer 等人。,2008, 舒尔茨等人。,2011)。骨的脂肪细胞和骨软骨病原群来自间充质和非造血、非内皮谱系。先前的工作也表明神经嵴衍生的 Nestin+细胞可能是这里描述的成人间充质细胞的发育起源 (Isern 等人。,2014, 森川等人。,2009b, Nagoshi 等人。,2008, 高岛等人。,2007)。
我们关于发育谱系、分化能力和脂肪细胞表型的数据表明,骨髓中的脂肪细胞祖细胞更接近于白色,而不是棕色的成脂细胞。这与之前的报告一致,但并不排除 WAT 和 MAT 在内分泌功能上的具体差异 (谢勒和罗森,2014)。然而,我们的 RNA-seq 分析表明,一些富含骨驻留前脂肪的基因也在承诺的棕色前脂肪细胞中表达。G., Ebf2, Entpd2, Fam129a,和 Acy3) (王等人。,2014),这将至少支持蝙蝠血统的一些潜在相似性 (Kring 等人。,2012)。
高脂饮食会迅速增加成脂的扩张,但不会增加成骨软骨病系的扩张。这种诱导在老年骨髓中更为明显。衰老是否也会影响脂肪组织常驻祖细胞亚群的膨胀能力仍有待确定,但我们的数据清楚地表明,这一过程可能参与与 MAT 积累相关的致病过程。这一观察得到了一份关于瘦素介导的饮食诱导骨髓脂肪生成的调节的报告的支持 (岳等人。,2016)。值得注意的是,在高脂饮食喂养后,OPCs 数量的减少仅在年轻动物中观察到,这可能是由于在老年动物中观察到的瘦素抵抗 (加布里埃尔等人。,2002) 但这也表明脂肪细胞的扩张可能不完全依赖瘦素。
Sca1+细胞,e.G.,多能 CD45?CD31?Sca1+CD24+人口,以及 apc 关联 L 型船舶已知主机 HSCs (西瓦拉杰和亚当斯,2016),并且发生在内胚层附近,因此可以很容易地影响造血细胞或促进成骨过程。有趣的是,骨居民群体中至少部分重叠群体的多能分化潜能,例如 p α s (Sca1+Pα+) 细胞,表达 LepR 的细胞,或巢蛋白表达的基质细胞,之前已经被描述过 (门德斯-费雷尔等人。,2010, 森川等人。,2009a, 岳等人。,2016, 周等人。,2014),但这些种群至少与这里描述的几个种群部分重叠。例如,几乎所有的 LepR+细胞是 p α+并包含所有 CD45?CD31?Sca1+细胞 (周等人。,2014)。我们对 CD45 的克隆分析?CD31?Sca1+CD24+细胞将这一群体确定为一个高度均匀的多能细胞库,表明在这种干细胞样子群体中额外的富集。为了支持这一观察,p α s 或 LepR 的克隆分析+细胞仅在可能来自表达 CD24 的亚群的较小的克隆子集中显示出多能性 (森川等人。,2009a, 周等人。,2014)。重要的是,多能干细胞样群体也促进造血再种群,并为表达造血维持细胞因子 CXCL12 的细胞富集 (格林鲍姆等人。,2013, 周等人。,2014)。与我们研究中定义的其他三种细胞类型相比,我们发现 CD45?CD31?Sca1+CD24+多能细胞也表达最高水平的Lepr和其他亲造血信号,如Kitl/Scf和Vcam1,因此,可以代表支持造血的间充质干细胞的进一步纯化步骤 (丁等人。,2012, 莱万多夫斯基等人。,2010)。总之,虽然我们不能排除骨中存在几个独立的成脂和成骨谱系,但我们的研究强烈建议 CD45?CD31?Sca1+CD24+细胞类型,WAT 中先前描述的脂肪干细胞的骨骼等价物 (Rodeheffer 等人。,2008),可以产生单方面致力于任一谱系的人群,并提供造血利基必不可少的维持信号。
与之前的报告一致 (陈等人。,2015, Steenhuis 等人。,2008),我们描述了一个承诺的 OPC 群体,该群体至少部分来自 CD45?CD31?Sca1+CD24+多能干细胞。表达特征的比较表明这些与先前描述的骨骼干细胞相对应 (陈等人。,2015),被认为是有助于出生后骨骼发育的两种不同的骨骼干细胞群体之一 (沃斯利等人。,2015)。在我们的研究中,Grem1MRNA 在所有人群中都检测到,但在多能细胞中含量最高。而沃斯利等人。(2015)清楚地表明 Grem1+细胞主要是 CD45?CD31?Sca1?骨骼干细胞,一小部分 Grem1+细胞也是 Sca1+因此也可以标记我们在这里描述的多能干细胞样的群体。需要进一步的工作来确定 CD45 的程度?CD31?Sca1+CD24+细胞有助于胚胎和成年阶段的成骨谱系。
异位脂肪细胞在骨髓腔中的积累被认为有助于与年龄相关的骨再生和造血损伤 (卡内维尔等人。,2014, 法泽利等人。,2013, Le 等人。,2016, Naveiras 等人。,2009, 施瓦茨,2015)。骨折和并发症的风险增加,如不愈合,与衰老和肥胖引起的 MAT 积累有关 (坚果和万向宝,2004)。骨愈合与初始炎症阶段密切相关,随后是软骨骨痂形成、纤维基质沉积以及随后通过成骨细胞矿化 (艾因霍恩和格斯滕菲尔德,2015)。我们在这里确定了在高脂肪饮食喂养和衰老过程中观察到的前脂肪生成转移的细胞基础。致力于成脂谱系的细胞不仅抑制骨愈合,还抑制急性造血重建。在长期造血恢复期间,脂肪细胞谱系的有限负面影响进一步表明,缺乏前脂肪生成刺激有利于骨内稳态。后续研究将必须确定这些影响是否也适用于不同的过程,如骨重塑而不是骨愈合,以及健康和病理垫子的亚型 (卡索恩等人。,2014, 谢勒等人。,2015) 以及在本研究中是否只分析雄性小鼠的性别特异性差异。这种对骨内稳态有害影响的潜在中介是 DPP4,因为它最近被证明会损害造血恢复和骨健康 (Broxmeyer 等人。,2012, 金和乔,2016, Monami 等人。,2011)。我们的结果提供了关于 DPP4 抑制剂通过靶向脂肪细胞谱系在骨再生过程中的有益作用的机制见解,并且它们可能将 MAT 作为 DPP4 的来源与全身性胰岛素抵抗的病理生理学联系起来。总之,我们在这里描述了 MAT 的本体和脂肪细胞谱系,它们对骨愈合和造血产生负面影响。这些发现表明,MAT 的积累会导致与年龄相关的骨髓细胞功能障碍,并可能与干扰骨组织修复和造血系统的适当维持的多种病理过程有关。
星★方法
关键资源表
试剂或资源 源 标识符
抗体
抗小鼠 Ly-6A/E (Sca-1) APC (克隆: D7) EBioscience 卡特彼勒 #: 17-5981
抗小鼠 Ly-6A/E (Sca-1) Alexa Fluor 700 (克隆: D7) EBioscience Cat #: 56-5981
抗小鼠 Ly-6A/E (Sca-1) APC/Cy7 (克隆: D7) Biolegend 卡特彼勒 #: 108125
抗小鼠 CD45 FITC (克隆: 30-F11) EBioscience 卡特彼勒 #: 11-0451
抗小鼠 CD45 APC (克隆: 30-F11) Biolegend 卡特彼勒 #: 103111
抗小鼠 CD45 PE (克隆: 30-F11) 生物科学 卡特彼勒 #: 12-0451
抗小鼠 CD31 (PECAM-1) FITC (克隆: 390) EBioscience 卡特彼勒 #: 11-0311
抗小鼠 CD31 (PECAM-1) APC (克隆: 390) EBioscience 卡特彼勒 #: 17-0311
抗小鼠 CD31 (PECAM-1) PE-Cyanine7 (克隆: 390) EBioscience 卡特彼勒 #: 25-0311
抗小鼠 CD140a (PDGF 受体 to) APC (克隆: APA5) Biolegend 卡特彼勒 #: 135907
抗小鼠 CD140a (PDGF 受体 a) PE (克隆: APA5) EBioscience 卡特彼勒 #: 12-1401
抗小鼠 CD24 APC-eFluor 780 (克隆: M1/69) EBioscience 卡特彼勒 #: 47-0242
抗小鼠 CD24 PE (克隆: 30-F1) EBioscience 卡特彼勒 #: 12-0241
抗小鼠 CD26 PerCP-Cyanine5。5 (克隆: H194-112) EBioscience 卡特彼勒 #: 45-0261
抗小鼠 cd45。1 PE (克隆: A20) EBioscience 卡特彼勒 #: 12-0453
抗小鼠 cd45。1 APC (克隆: A20) EBioscience 卡特彼勒 #: 17-0453
抗小鼠 cd45。2 Alexa Fluor 700 (克隆: 104) EBioscience Cat #: 56-0454
抗小鼠 CD11b PE (克隆: M1/70) EBioscience 卡特彼勒 #: 12-0112
抗小鼠 Ly-6G (Gr-1) PE (克隆: RB6-8C5) EBioscience 卡特彼勒 #: 12-5931
抗小鼠 CD19 APC-eFluor 780 (克隆: eBio1D3) EBioscience 卡特彼勒 #: 47-0193
抗小鼠 CD3e APC-eFluor 780 (克隆: 145-2C11) EBioscience 卡特彼勒 #: 47-0031
小鼠造血谱系 FITC 鸡尾酒 (克隆: 17A2,RA3-6B2,M1/70,TER-119,RB6-8C5) EBioscience 卡特彼勒 #: 22-7770
抗小鼠 CD117 (c-Kit) APC (克隆: 2B8) EBioscience 卡特彼勒 #: 17-1171
抗小鼠 CD34 Alexa Fluor 700 (克隆: RAM34) EBioscience Cat #: 56-0341
抗小鼠 CD16/CD32 PE-Cyanine7 (克隆: 93) EBioscience 卡特彼勒 #: 25-0161
兔抗 RFP (tdTomato) Abcam 卡特彼勒 #: ab62341
山羊抗 GFP NovusBiologicals 猫 #: NB100-1770
大鼠 anti-CD45 NovusBiologicals 猫 #: NB100-77417
山羊抗 Perilipin Abcam 卡特彼勒 #: ab61682
兔抗 Perilipin 西格玛 卡特彼勒 #: P1873
大鼠 anti-CD31 Dianova 猫 #: DIA-310
大鼠 anti-Sca1 Abcam 卡特彼勒 #: ab25195
大鼠抗 BrdU Cedarlane 卡特彼勒 #: CL2700AP
鼠标抗聚合蛋白 默克密理博 卡特彼勒 #: MABT84
山羊抗骨钙素 BioRad 卡特彼勒 #: 7060-1815
山羊 anti-CD24 Abcam 卡特彼勒 #: ab202963
Alexa Fluor 488 山羊抗兔 Abcam 卡特彼勒 #: ab150077
Alexa Fluor 488 鸡抗山羊 生活技术 猫 #: A-21467
Alexa Fluor 488 驴防鼠 生活技术 猫 #: A-21208
Alexa Fluor 488 山羊抗小鼠 Abcam 卡特彼勒 #: ab150113
Alexa Fluor 568 山羊抗兔 Abcam 卡特彼勒 #: ab175471
Alexa Fluor 594 驴反兔 生活技术 猫 #: A-21207
Alexa Fluor 594 驴反山羊 Abcam 卡特彼勒 #: ab150132
Alexa Fluor 680 驴反兔 赛默飞世尔 卡特彼勒 #: A10043
抗 β-肌动蛋白过氧化物酶结合 西格玛 卡特彼勒 #: A3854
抗人/小鼠 UCP1 研发系统 卡特彼勒 #: MAB6158
过氧化物酶山羊抗小鼠 Abcam 卡特彼勒 #: ab97023
化学品、肽和重组蛋白
钙黄绿素 EBioscience Cat #: 65-0855-39
碘化丙啶 (PI) 西格玛 卡特彼勒 #: P4170
重组小鼠 DPPIV/CD26 蛋白 研发系统 卡特彼勒 #: 954-SE
双蛋白 A (Ile-Pro-Ile) 西格玛 卡特彼勒 #: I9759
西格列汀 Biomol 卡特彼勒 #: Cay-13252-250
Cal-Rite 固定剂 赛默飞世尔 卡特彼勒 #: 10599428
Roti-组织修复程序 4% 卡尔 · 罗斯 卡特彼勒 #: p087。3
苏丹黑 B 西格玛 卡特彼勒 #: 199664
氟蒙特-G EBioscience 类别 #: 00-4958-02
油红 O 西格玛 卡特彼勒 #: O0625
茜素红 S 卡尔 · 罗斯 猫 #: A5533-25G
Alcian 蓝色 8GX 西格玛 卡特彼勒 #: A3157
水晶紫罗兰 西格玛 卡特彼勒 #: C0775
BrdU 西格玛 卡特彼勒 #: B5002
D-荧光素-K + 盐生物发光底物 珀金 · 埃尔默 卡特彼勒 #: 122796
MCDB201 媒体 西格玛 卡特彼勒 #: M6770
地塞米松 西格玛 猫 #: D-4902
L-抗坏血酸 2-磷酸盐 西格玛 卡特彼勒 #: A8960
胰岛素-转铁蛋白-硒 (ITS) 混合物 西格玛 卡特彼勒 #: I3146
亚油酸-白蛋白 西格玛 卡特彼勒 #: L9530
表皮生长因子 PeproTech 卡特彼勒 #: 315-09
白血病抑制因子 MerckMillipore 卡特彼勒 #: ESG1107
血小板衍生生长因子 BB PeproTech 卡特彼勒 #: 315-18
碱性成纤维细胞生长因子 西格玛 卡特彼勒 #: F0291
吲哚美辛 西格玛 卡特彼勒 #: I7378
重组人胰岛素 罗氏 卡特彼勒 #: 11376497001
Isobutylmethylxanthine 西格玛 卡特彼勒 #: I5879
3,3 ′,5-triiodo-L-thyronine (T3) 西格玛 卡特彼勒 #: T6397
β-磷酸甘油 西格玛 卡特彼勒 #: G9891
左旋甲状腺素 西格玛 卡特彼勒 #: T0397
转化生长因子 β 1 PeproTech 卡特彼勒 #: 100-21
关键商业化验
DPP4 ELISA 赛默飞世尔 卡特彼勒 #: EMDPP4
RNeasy Plus 微型套件 QIAGEN 卡特彼勒 #: 74034
更智能的 PCR cDNA 合成试剂盒 Clontech 卡特彼勒 #: 634925
优势 2 PCR 试剂盒 Clontech 卡特彼勒 #: 639207
生物分析仪 DNA 高灵敏度试剂盒 安捷伦科技 卡特彼勒 #: 5067
Nextera XT DNA 样品制备试剂盒 Illumina 猫 #: FC-131
Nextera 索引套件 Illumina 猫 #: FC-131
存储数据
RNA 序列数据 欧洲核苷酸档案 (ENA),http://www.ebi.ac.uk/ena ENA: ERP013883
实验模型: 生物体/菌株
鼠标: R6/2: C57BL/6J 杰克逊实验室 JAX: 000664
鼠标: R6/2: B6 (Cg)-Tyrc-2J/J 杰克逊实验室 JAX: 000058
鼠标: R6/2: b6。Cg-Tg (Gt (ROSA) 26Sor-EGFP) I1Able/J 杰克逊实验室 JAX: 007897
鼠标: R6/2: b6。129S4-PdgfraTm11 (EGFP) Sor/J 杰克逊实验室 JAX: 007669
鼠标: R6/2: B6;FVB-Tg (Zfp423-EGFP) 7 Brsp/J 杰克逊实验室 JAX: 019381
鼠标: R6/2: b6。SJL-Ptprca Pepcb/BoyJ 杰克逊实验室 JAX: 002014
鼠标: R6/2: b6。129 (Cg)-Gt (罗莎) 26SorTm4 (ACTB-tdTomato,EGFP) 罗/J 杰克逊实验室 JAX: 007676
鼠标: R6/2: FVB。129S6 (B6)-Gt (罗莎) 26SorTm1 (Luc) Kael/J 杰克逊实验室 JAX: 005125
鼠标: R6/2: b6。Cg-Tg (Prrx1-cre) 1Cjt/J 杰克逊实验室 JAX: 005584
小鼠: R6/2: C57BL/6-Tg (Pdgfra-cre) 1Clc/J 杰克逊实验室 JAX: 013148
鼠标: R6/2: B6;FVB-Tg (Adipoq-cre) 1 Evdr/J 杰克逊实验室 JAX: 010803
鼠标: R6/2: B6;129-Tg (Cdh5-cre) 1Spe/J 杰克逊实验室 JAX: 017968
鼠标: R6/2: b6。Cg-Tg (Vav1-icre) A2Kio/J 杰克逊实验室 JAX: 008610
鼠标: R6/2: b6。Cg-Tg (Tek-cre) 1Ywa/J 杰克逊实验室 JAX: 008863
鼠标: Dpp4Tm1Nwa Marguet 等人。,2000 MGI 标识: 2150161
基于序列的试剂
QPCR 引物组: 请参见表 S6 这篇论文 N/A
在新选项卡中打开表
联系试剂和资源共享
对于资源和试剂的进一步信息和要求可能会被引导到并将由首席联系人提姆 J 完成。舒尔茨 (蒂姆。舒尔茨 @ dife。德)。本研究中使用的动物菌株由相应菌株提供者制备的 MTAs 覆盖。
实验模型和主题细节
所有程序都由国家环境、健康和消费者保护办公室 (德国勃兰登堡州) 的动物福利伦理委员会批准。动物被安置在受控环境中 (20 ± 2 ℃,12/12 小时亮/暗循环),保持在 SD (德国索斯特市 Ssniff), 或者喂养一个 HFD (45% 能量来自脂肪,D12451,研究饮食,新不伦瑞克,新泽西州,美国) 1 和 10 天。雄性小鼠在指定的适用年龄用于所有实验。所有以下小鼠菌株都是从杰克逊实验室获得的: C57BL/6J,B6 (Cg)-Tyrc-2J/J (B6-albino),b6。Cg-Tg (Gt (ROSA) 26Sor-EGFP) I1Able/J,b6。129S4-PdgfraTm11 (EGFP) Sor/J (p α-eGFP 报告),B6;FVB-Tg (Zfp423-EGFP) 7 Brsp/J (Zfp423-eGFP 记者),b6。SJL-Ptprca Pepcb/BoyJ (cd45。1),B6.129 (Cg)-Gt (罗莎) 26SorTm4 (ACTB-tdTomato,EGFP) 罗/J(MTmG-记者),FVB。129S6 (B6)-Gt (罗莎) 26SorTm1 (Luc) Kael/J(Rosa26-Luciferase 记者),b6。Cg-Tg (Prrx1-cre) 1Cjt/J,C57BL/6-Tg (Pdgfra-cre) 1Clc/J,B6;FVB-Tg (Adipoq-cre) 1 Evdr/J,B6;129-Tg (Cdh5-cre) 1Spe/J,b6。Cg-Tg (Vav1-icre) A2Kio/J,b6。Cg-Tg (Tek-cre) 1Ywa/J。菌株 Dpp4Tm1Nwa (Marguet 等人。,2000;DPP4-KO) 是由博士维持的殖民地提供的花风扇从查理大学,柏林,德国。在造血 (Vav1) 、内皮 (Cdh5 和 Tek/Tie2) 、间充质 (Prx1 和 pdgfr α) 或成熟脂肪细胞 (AdipoQ) 的启动子控制下表达 Cre 重组酶的小鼠菌株谱系标记与 mTmG 报告小鼠品系交叉,该品系组成地表达了膜结合红色荧光蛋白 tdTomato (来自 loxP 侧翼 cDNA)。Cre 介导的重组导致 td番茄盒的切除,并激活绿色荧光蛋白的表达。对于移植实验,Zfp423-eGFP 报告小鼠要么与 mTmG 报告小鼠交叉 (repTdTom),或者对 AdipoQ-Cre 小鼠和一个表达荧光素酶的 lox-Stop-lox 报告菌株,在 Cre 介导的从 Rosa26-locus 中移除 floxed 停止盒后 (repAdiLuc)。在整个研究过程中使用新鲜分类的小鼠原代细胞,并通过 FACS 分离和培养,如前所述 (舒尔茨等人。,2011, Steenhuis 等人。,2008)。因此细胞没有被认证。对于培养,添加 60% DMEM 低糖 (非甾体) 和 40% MCDB201 (西格玛) 的复合培养基,100 U/mL 青霉素和 1,000 U/mL 链霉素 (非甾体)。2% FBS,1 × 胰岛素-转铁蛋白-硒 (ITS) 混合物,1 × 亚油酸与 BSA 共轭,1 nM 地塞米松和 0。加入 1 毫米 L-抗坏血酸 2-磷酸盐 (全部来自西格玛)。使用前,将生长因子添加到培养基中: 10 纳克/毫升表皮生长因子 (PeproTech),10 纳克/毫升白血病抑制因子 (merckmillpore), 10 纳克/毫升血小板衍生生长因子 BB (PeproTech) 和 5 纳克/毫升碱性成纤维细胞生长因子 (bFGF;西格玛-奥尔德里奇)。在整个培养期间每天添加 bFGF,除非另有说明。对于脂肪分化细胞,在扩张三天后诱导 48 小时,随后分化为 5 天。对于成脂分化,诱导培养基 (不含生长因子的生长培养基) 含有 5 μ g/mL 人胰岛素 (罗氏应用科学),50 μ m 吲哚美辛,1 μ m 地塞米松,0。5 μ m 异丁基甲基黄嘌呤,1 nM 3,3 ′,5-三碘-l-甲状腺原氨酸 (T3) (全部来自 Sigma-Aldrich) 加入 48 小时, 随后在没有生长因子的生长培养基中进一步分化,仅添加 T3 和胰岛素。油红 O 染色是通过在室温下用 4% 的组织修复物固定细胞 15 分钟来进行的。用于制备油红 O 的工作溶液,一 0。异丙醇中 5% 的储备溶液以 3:2 的比例用蒸馏水稀释。工作溶液被过滤并在室温下应用于固定细胞至少一个小时。在评估前,用自来水洗涤细胞四次。为了定量,油红 O 通过加入一定体积的异丙醇来提取,吸光度在 510 纳米的微板阅读器 (协同 H1,BioTek) 中读取。为了诱导成骨分化,预融合细胞补充成骨培养基 (DMEM 低糖 (invitraw)),10% FBS,100 nM 地塞米松,0。2 毫米 L-抗坏血酸 2-磷酸,10 毫米 β-甘油磷酸和 50 纳克/毫升 L-甲状腺素) 14 天。然后将细胞用福尔马林固定并在蒸馏水中用 2% 茜素红 S (Roth) 染色。用 PBS 冲洗两次,用蒸馏水冲洗一次。通过加入 10% 十六烷基吡啶氯化物溶液,进行去染色以定量测定矿化。吸光度在 570 纳米的微板阅读器 (协同 H1,BioTek) 中测量。微质量培养用于软骨形成试验。为此,5 μ l 细胞悬浮液滴 (appr。1。5 × 107细胞/毫升) 在孔 (48 孔板) 的中心被移液。在培养箱中培养 2 小时后,用 10% FBS 、 100 nM 地塞米松、 1 μ m L-抗坏血酸-2-磷酸、添加 10x 其混合物和 10ng/ml 转化生长因子 β 1)。细胞介质每隔一天更换一次。21 天后,将细胞固定并在室温下用 1% Alcian-Blue 染色 (Sigma) 30 分钟。用 0 冲洗细胞三次。1 M HCl。为了中和酸度,在微观分析之前,用 dH2O 进行了洗涤步骤。对于 DPP4 体外实验,细胞群通过如上所述的成脂或成骨试验进行分化。小鼠重组 DPP4 (250 ng/mL;研发系统) 或 DPP-4 抑制剂西格列汀 (100 微米;从脂肪形成的第 3 天 (成脂诱导) 或骨形成的第 0 天开始添加到分化鸡尾酒中,直到分化实验结束。DPP4 分泌到细胞培养基中是通过酶联免疫吸附试验测定的。使用新鲜分离的胫骨外植体的上清液在培养基中保持 24 小时,或者在脂肪分化 10 天后从细胞群中提取上清液。CFU-F 试验进行如下: 新鲜分离的细胞群接种在膨胀培养基中,每 6 孔板 500 个细胞。介质每隔一天更换一次。在第 10 天,细胞被固定并用结晶紫 (Sigma) 染色。由 20 多个细胞组成的菌落被算作 CFU。每个细胞群体至少进行了 6 次独立检测。对于总回收率实验,细胞群按照 CFU-F 分析的描述进行接种。通过使用 ImageJ 软件定量孔板表面的总细胞侵袭面积,在第 7 、 11 和 15 天进行固定和结晶紫染色细胞群的分析。
方法详细信息
流式细胞术和细胞分选
流式细胞术和细胞分选在 FACS Aria III 细胞分选仪 (BD 生物科学) 上进行,并使用 FlowJo 软件 (Tree Star) 进行分析。软组织游离骨 (胫骨/股骨) 用骨剪刀压碎,在 37 ℃ 的摇晃水浴中孵育 1 小时,在 10 毫升含 0 的 20% FBS/PBS 中孵育 1 小时。5% 2 型胶原酶 (细胞系统)。通过 70 μ m 网格过滤悬浮液以去除骨碎片,并在 4 ℃ 以 1200 rpm 离心 5 分钟。将沉淀重新悬浮在 ACK (氯化铵-钾) 裂解缓冲液中,以消除红细胞,并在 4 ℃ 下以 1200 rpm 再次离心 5 分钟。将沉淀重新悬浮在 100 μ l 分选缓冲液 (2% FBS/PBS) 中,并在 4 ℃ 下用抗体染色至少 30 分钟。应用的 FACS 抗体可以在关键资源表.活细胞因缺乏碘化丙啶而被门控;1:1,000 稀释原液: 1 μ g/mL 在水中) 钙蛋白酶的荧光和积累 (1:1,000 稀释;215 μ l 二甲基亚砜中的 1 毫克储备)。补偿、基于荧光负一控制的门控和 FACS 分离在使用抗体组合之前如各自的图表和图例中所述进行 (舒尔茨等人。,2011)。
单细胞克隆试验
对于共培养方法,CD45 的馈线层-CD31-Pα+从 8 周龄雄性 C57BL/6J 小鼠的长骨中分离细胞,并在 96 孔板的每孔 100 个细胞的 750 μ l 膨胀培养基中接种。第二天,单个 CD45-CD31-Sca1+CD24+TdTomato+新鲜分离的 8 周龄雄性 Rosa26-mTmG 小鼠的细胞被分类到每个孔中。细胞扩张 10 天,以每隔一天与介质变化亚融合。10 天后,单个细胞的克隆扩增通过荧光显微镜进行验证。含有易于检测到的 td番茄单菌落的井+细胞被胰蛋白酶化,洗涤,并收集在 100 μ l 分选培养基中。每个克隆的五到十个细胞 (每个条件) 被直接分类到新鲜制备的扩展 CD45 的 96 孔板喂料器层上-CD31-Pα+用于成脂和成骨分化方案的细胞,或用于软骨分化的微团培养物。在分化试验结束时,通过免疫细胞化学分析克隆的分化能力。一个转基因番茄阳性克隆被认为是脂肪生成的,如果它与 Perilipin 共染色,成骨的,如果它与骨钙素共染色,和软骨的,如果它与聚集蛋白共染色。或者,在无饲养者细胞测定中,单个 CD45-CD31-Sca1+CD24+从 8 周龄雄性 C57BL/6J 小鼠中新鲜分离的细胞被分类到 96 孔板的孔中,没有饲养层细胞。单细胞扩张 10 天,介质每隔一天变化一次。10 天后,产生菌落的克隆被重新播种在一个新的 96 孔板中,并扩展到亚融合。然后将克隆用于三分化分析。在分化结束时,对脂肪形成和免疫细胞化学进行油红 O 染色,用于成骨 (骨钙素) 和软骨形成 (聚合蛋白)。用 Keyence BZ-9000 (Biorevo) 荧光显微镜获得图像。
组织学
分离的骨头从周围组织中清理出来,用 Richard-Allan science Cal-Rite 固定剂 (热科学) 固定/脱钙,然后进行石蜡包埋。切片 (3 μ m) 用于免疫组织学染色或 H & E 概述染色。对于免疫组织化学切片,在二甲苯中脱链并重新水化,降低乙醇浓度。热介导的抗原检索是通过在封闭缓冲液 (40 毫米 Tris 和 1。2 毫米 EDTA 在蒸馏水中) 在 330 瓦的微波中 5 分钟。幻灯片用于冷却并用水冲洗。用 PAP 笔 (Kisker) 圈出几乎干燥的样品,并在室温下用封闭溶液 (1% BSA/PBS) 孵育 60 分钟。在 1% BSA/PBS 中稀释的初级抗体被加入,样品在 4 ℃ 的加湿室内孵育过夜。切片用 PBS 洗涤三次。第二抗体和 DAPI 核染色在室温下在黑暗中应用 10 分钟。样品用 PBS 洗涤两次。减少自动荧光 0。应用 3% 苏丹黑溶液 (70% EtOH) 20 分钟。切片被洗涤三次,并用荧光计 G (eBioscience,GER) 安装。在通过荧光显微镜评估之前,样品在 4 ℃ 下储存在黑暗中。对于不同的骨居民群体的定量,骨髓区为 0。05毫米2从骨骼切片中选择荧光图像。对于免疫细胞化学,固定在孔板中的细胞被 0 渗透。1% Triton X-100 溶液,并用 3% BSA 在 PBS 中封闭。抗体作为所列关键资源表.对于核染色标本用 DAPI 处理。使用 Keyence BZ-9000 (Biorevo) 荧光显微镜 (最多两个荧光) 或蔡司共聚焦激光扫描显微镜 (LSM) 700 (三个荧光) 分析切片和细胞。
胸骨移植
已排序的细胞群 (参见图 S2L) 来自荧光素酶表达代表AdiLuc或者 td番茄表达代表TdTom小鼠皮下注射 1。5 × 10450% 基质凝胶悬浮液中的细胞进入 B6-albino 小鼠的胸骨区域。移植后 8 周,切除、固定并进行组织学分析。给小鼠注射来自 rep 的细胞Luc在牺牲前,动物还用 IVIS 成像系统 (Perkin Elmer) 进行了荧光素酶成像。为此,动物腹腔注射荧光素 (150 mg/kg),随后麻醉。12 到 18 分钟后,对动物进行成像。图像分析是用活图像 4 进行的。4 软件 (Xenogen)。
BrdU 细胞增殖体内测定
在 24 小时的实验中,小鼠是 i。P.-注射 100 mg BrdU/kg (Sigma Aldrich) 的单剂量稀释在无菌 PBS 中。接受 SD 或 HFD 10 天的小鼠通过饮用水以 0 的浓度给予 BrdU。5 mg/mL。饮用水每隔一天更新一次。对于大约 2 × 10 的单细胞免疫染色3每个感兴趣群体的细胞/小鼠在预先涂有 5 μ l DMEM 滴 (低) 的玻璃盖玻片上进行双重分类。盖玻片孵育 30 分钟,允许细胞附着。通过轻轻加入 4% 的组织固定物 10 分钟,用 PBS 洗涤三次 3 分钟来固定细胞。透化溶液 (0。2% 皂苷/PBS) 应用 6 分钟。洗涤液 (0。02% 皂苷/PBS) 5 分钟,然后施用 DNA 变性溶液 (2 M HCl 在 0。02% 皂苷/PBS) 在 37 ℃ 下 20 分钟。将细胞洗涤 5 分钟,并用 2% BSA 在洗涤液中堵塞 30 分钟。用抗 BrdU 抗体 (Cedarlane) 在封闭溶液中孵育 4 ℃ 过夜。第二天,三次清洗 10 分钟,用 Alexa Fluor 488 驴防鼠孵化 (渔夫科学) 并在室温下黑暗中进行封闭溶液中 30 分钟的 DAPI 染色。用洗涤液和 PBS 洗涤细胞三次。盖玻片安装了荧光点 G (eBioscience)。在通过荧光显微镜 (Keyence) 评估之前,样品在 4 ℃ 下储存在黑暗中。与 DAPI 阳性细胞总数相比,计算每个群体中 BrdU 阳性细胞的百分比。
竞争性造血重建试验
动物在实验前一周两天通过饮用水和镇痛药给予抗生素。C57BL/6J 受体小鼠用单次剂量 7 进行致死性照射。5 Gy。对于重建试验,150 LT-LSK 来自表达 cd45 的供体小鼠的细胞。1 个等位基因与 1 × 10 混合5新鲜分离全骨髓支持细胞 (收集冲洗 BM 长骨) C57BL/6J 小鼠 (CD45.2) 除了 1。5 × 104从 rep 分离的一个调查群体的细胞Dtom小鼠,然后通过近端关节面在胫骨髓腔内注射。为了研究急性效应,照射后五周,用流式细胞术分析外周血、胫骨骨髓和胫骨骨。对于长期实验,每四周取一次血,照射后 16 周对胫骨骨髓和胫骨进行分析。将红细胞溶解,然后进行抗体染色以区分不同的血细胞群 (如关键资源表)。对于供体嵌合的评估,供体部分的频率 (cd45。1+: CD45.2-) 已计算。
断裂模型
小鼠被给予一种镇痛药 (MediGel,ClearH2O) 手术前两天开始。麻醉小鼠注入 1。5 × 10450% 基质凝胶悬浮液中的细胞穿过胫骨近端关节面。钢销 (直径 0。35毫米) 插入髓腔稳定,用剪刀 0 诱发骨折。距离膝盖 5厘米远。在骨折诱导后的指定时间点,收集 tibiae 进行分析。从提取的 tibiae 中取出 pin 后,使用制造商预先定义的用于孤立骨测量的参数,使用 LaTheta LCT-200 (日立-Aloka) 进行 μ ct 分析。或者,tibiae 被固定和脱钙,然后以每片 3 μ m 的石蜡包埋和切片。样本使用 SafraninO/Fast green 和 Movat 五旬节进行染色。ImageJ 软件用于计算机辅助的骨折胼胝体组织形态计量学分析。每个骨痂的六个代表性部分以盲法分析骨、纤维和软骨组织区域。对于 DPP4 体内实验,小鼠接受每日剂量的 PBS,Diprotin a (5 毫克/千克体重;西格玛) 或西格列汀 (10 毫克/千克体重;生物醇) i.P.连续 9 天。对于骨折愈合实验,应用程序在损伤/细胞注射诱导前两天开始。在最后一次 DPP4-inhibitor 给药后一天评估骨折愈合情况。
细胞群的捕获、文库制备和测序
总共 17,000 CD45-CD31-Sca1-Zfp423+50,000 CD45-CD31-Sca1+CD24-5,000 CD45-CD31-Sca1+CD24+30,000 CD45-CD31-Sca1-Pα+细胞从 4 只小鼠的骨骼中进行分类 (3 个生物复制在 3 个不同的日子进行),收集在 1。5 毫升 Eppendorf 管含有 50 μ l RLT 加缓冲液 (QIAGEN),补充 1% 2-巯基乙醇,立即在干冰中冷冻并保持在-80 ℃。小鼠安乐死和 FACS 程序终止之间的时间为 400 分钟。RNA 提取,逆转录和 cDNA 预扩增,Nextera XT 库和细胞群的测序是如前所述并根据制造商的说明完成的。简而言之,使用 RNeasy Plus Micro Kit (QIAGEN) 和基因组 DNA 消除器 (QIAGEN) 提取 RNA。使用智能 PCR cDNA 合成试剂盒 (Clontech) 和优势 2 PCR 试剂盒 (Clontech) 进行逆转录和 cDNA 预扩增。用生物分析仪 DNA 高灵敏度试剂盒 (安捷伦科技) 采集并量化 cDNA。使用 Nextera XT DNA 样品制备试剂盒和 Nextera 索引试剂盒 (Illumina) 制备文库。多路复用的库被汇集,成对的端 100-bp 测序是在 ligha HiSeq 2500 的一个流式细胞 (两条通道) 上进行的。
RNA-seq 数据处理和分析
测序数据与小家鼠基因组 (Ensembl 版本 38。82) 使用带有默认参数的 GSNAP (版本 2014-10-07)。HTseq-count 用于计算映射到每个基因的读取数 (默认选项)。几乎所有的图书馆都显示出良好的质量,大小在 2-3 之间。5x107读取计数和映射到大于 75% 的外显子的读取的一小部分 (图 S7)。一个库产生的读数少于 300,并且被排除在下游分析之外。使用大小因子将数据标准化为测序深度。每个库中表达的前 1,000 个基因的联合被选择,这导致了 2,120 个基因的列表。对标准化的 log10-transformed 标准化计数进行主成分分析 (在添加 1 的伪计数以避免无穷大之后)。在同一数据集上使用欧几里得距离和 Ward 的方法进行分层聚类分析。通过使用生物导体 R-包 DESeq2 文库在 FDR 为 0 时鉴定文库组之间的差异表达基因。1。在分析之前,没有在任何库中检测到的基因被移除,并且可能的混淆因素被考虑在内 (i.E.,每个样本的动物)。使用 R 统计包和古生物学统计 (过去,版本 3) 对 RNA-seq 数据进行统计分析。10,http://folk.uio.no/ohammer/past/,于 2015年12月访问)。对于 DE 分析,对所有被调查的细胞群体的基因表达进行比较。P值 <0。05 被用作差异表达基因的截止点。热图包含有代表性的顶级调节基因,这些基因被先前文献中描述的已知细胞类型的特定功能和未知的新标记基因进一步划分。
基因表达分析
使用之前描述的标准方法进行总 RNA 分离和基因表达分析 (舒尔茨等人。,2011) 在定量实时 PCR 期间,使用基于柱的 RNA 分离、 cDNA 合成的逆转录和基于 SYBR green 的检测。引物序列如中所述使用关键资源表.
量化和统计分析
所有数据以平均值 ± 标准误差 (SEM) 表示。每个实验的样本大小和实验的复制数量都包含在图例中。统计学意义定义为 p <0。05。使用未配对的双尾学生 t检验或 Mann-Whitney-U 检验进行统计分析,适用于两组之间的比较, 方差分析测试用于涉及两组以上的实验 (GraphPad Prism;版本 6。04)。
数据和软件可用性
数据资源
本研究报告的 RNA-seq 数据生成的基因表达数据的登录号为 ENA: ERP013883 (http://www.ebi.ac.uk/ena)。
作者贡献
T.H.A.和 T。J.S.构思了这项研究并写了手稿。T.H.A.进行了大部分的实验。A.西拉多,AG.,A.-M.J.,L.W.,C.B.,和 S。G.为这项研究做出了贡献。A.舒尔曼,HF.,和 D。W.L.为文章贡献了宝贵的材料和专业知识。L.R.S.进行实验并帮助撰写手稿。
确认
这项工作得到了欧洲研究理事会的支持 (ERC-StG 311082 至 TJ.S.),德国研究基金会的埃米·诺特项目 (DFG;授予 SCHU 2445/2-1 至 TJ.S.),以及德国教育和研究部 (BMBF) 和勃兰登堡州的赠款 (DZD 赠款 82DZD00302 至 aS.和 T。J.S.)。我们妮可非常感谢 Dittberner 、 Susann Richter 水团花属和来自德国人类营养研究所的 Elisabeth Meyer 提供的技术援助,以及来自马赛-卢米尼免疫中心的 Didier Marguet 提供的 DPP4-knockout 菌株。关于在骨髓脂肪生成和骨愈合中使用 DPP4 抑制剂的临时专利申请已经提交给 T。H.A.,L.R.S.,和 T。J.S.作为发明家。
上一篇:如何准备CRC面试?
下一篇:成年人也可以通过锻炼增高的成功
最近更新汽车资讯
- 哲学沙龙
- 高原痛风临床研究
- 快播插件(SPSS无法启动因为应用程序的并行配置不正确)
- 教育部2021年工作要点:加强普通高校毕业生就业工作
- 【陪你母乳喂养】 哎哟喂,没生孩子也能泌乳?
- 重组家庭没有血缘关系的兄妹可以结婚吗
- 非现役人员生活待遇经费保障与管理探析
- 《发展心理学·从生命早期到青春期》基础理论读书笔记--结合教育动画的相关研究
- 2023届河南省郑州市(二模)高中毕业第二次质量预测语文试题及答案.docx
- 《那片星空那片海》全集剧情简介 分集剧情介绍
- 给6-15岁男孩女孩的精选主题书单(分性别,暑假必备)
- 优秀家长家庭教育经验分享5篇
- 郭洪雷:汪曾祺小说“衰年变法”考论
- 章子怡汪峰吵架原因 章子怡与汪峰吵架事件详情
- 情感故事:不回家的女人
- 道德伪善的教育学思考
- 2018级高职医学影像技术专业人才培养方案
- 以国家之名的罪恶——评德国影片《窃听风暴》
- 影视传播范文10篇
- 九天揽月一一敢峰证明四色定理之谜
- 挪威流产或人工流产后妊娠的妊娠间隔和不良妊娠结局(2008-2016 年):一项
- 好看的美剧排行榜(12部高分高质美剧推给你)
- 解放思想大讨论心得体会
- 长谈 | 内蒙古电影新浪潮:现实的结构与质感
- 美国《国家性教育标准》及其启示(下)
