 手机访问:wap.265xx.com
手机访问:wap.265xx.com靶向治疗是现在治疗癌症的最好手段吗?它有什么优点和局限?
本题已收录至知乎圆桌 ?不再「谈癌色变」,更多相关话题欢迎关注讨论。
最近老看见癌症靶向治疗效果不错的新闻,外行想了解一下靶向治疗的情况?
重点是要有靶 不是每个人都有 谢邀
谢邀。
有点主要是副作用小,同时对一小部分肿瘤患者的效果能非常的好。这部分的患者主要是靶点通路dependent的,抑制了这个靶点对肿瘤效果非常的好。
缺点就多了,第一是贵,大几万甚至10几万一个月。第二就是耐药,由于肿瘤的异质性太大,大多数肿瘤患者体内的肿瘤细胞都不会是完全对这个靶点敏感的。总会有一些肿瘤细胞可以通过其他的通路代偿这个靶向药物抑制的细胞通路,让一些肿瘤细胞活下来,所以可能一开始能看到肿瘤小了,好像是有效果了,但是一段时间以后又长回去了。
这些缺点主要是因为现在的靶向治疗也还算是刚刚发展起来,很多药物敏感的机制,耐药的机制,适合什么类型的患者及有什么分子marker的肿瘤细胞更适合接受这个靶向药物治疗的这些方面还都没有完全研究清楚。 同时大家也都认为单一的靶向药物治疗可能效果不会那么好。现在也有很多人在研究联合不同细胞通路的靶向药物一起来,希望能得到更好的疗效。
总的来说,现在的靶向治疗就像是在买彩票。能完全有效的就像花很多钱去博大奖的几率应该是差不多的。
所以最好的可能说不上,而且就算以后靶向很成熟了,常规的手术放化疗应该还是少不了的。我以为的最理想的治疗方式是用常规三大治疗处理掉大多数肿瘤细胞,然后加靶向免疫这些方法针对少数残留的肿瘤细胞。因为常规的三大治疗都算是大规模杀伤手段,来的比较直接,效果也快。靶向免疫这些针对少量的残留病灶可能会有很好的效果。这样想应该算是最有发展前景的,最可能在肿瘤治疗方面有突破的治疗方法之一了吧。
题主谢邀!我想就我在结直肠癌领域的一些临床观察谈谈肿瘤靶向药物的特点。
众所周知,目前结直肠癌的发病率和死亡率在国内不断上升(国外由于患者依从性强,且该肿瘤手术、化疗效果好,死亡率开始下降),已成为继肺癌、胃癌之后的第三大癌症。在结直肠癌患者中,目前的研究表明,只有一类患者有应用靶向药物的指征——晚期转移患者。所以,如果不是IV期的肠癌病人,有人建议你用靶向治疗的话,那应该就是在忽悠你了(至少目前的指南是不推荐的,若干年后的变化答主也无法预测)。
目前,在临床上已广泛应用的结直肠癌靶向药物主要有两种:①爱必妥,学名西妥昔单抗,主要针对EGFR(Epidermal Growth Factor Receptor 表皮生长因子受体);②安维汀,学名贝伐珠单抗,主要针对VEGFR(Vascular Endothelial Growth Factor Receptor 血管内皮生长因子受体 )。目前的临床决策,以浙二医院肿瘤外科为例,晚期患者如果确定要使用靶向药物,首先需要对其肿瘤组织的白片(未经染色的切片)进行基因检测,主要检测的基因为一种名叫Ras的基因。若患者是野生型,那么久用爱必妥;若患者是突变型,那么这种患者使用爱必妥无效,则应用安维汀。
有的网友可能就有疑问了,那这是否说明爱必妥比安维汀好呢?其实,目前的研究,没有明显的证据证明两种药物孰优孰劣,对于晚期存在远处转移的患者,我看到过许多成功控制转移灶的病例(不是治愈,只是控制,病人和肿瘤共同生存),但是也都有即使用药疾病仍然进展的例子。相比于爱必妥出现皮疹的副作用,安维汀由于作用于VEGFR,其目的是抑制肿瘤血管生成,所以难免对正常血管也有伤害。所以,安维汀一个巨大的潜在危险就是出血,有时候患者肠道血供异常甚至会造成肠道穿孔。所以,在临床上,若不是Ras基因突变,我们对晚期肠癌的首选均是先采用爱必妥。
至于具体的用药方案,因为IV期肠癌的治疗目前没有明确的用药指南,需要经过多学科讨论(MDT)制定个体化治疗策略,目前我在临床上见过至少4种以上方案,且对同一个患者随着疾病的变化方案会不断改变,在此暂且不详述。
最后讲讲肠癌靶向药物的利弊。
优点:
1.对于敏感性高的患者,靶向药物确实能够控制疾病。见过肝脏多发转移得一塌糊涂的患者,按照常理生存期小于3个月,但是经过靶向治疗(一般临床不是单单靶向,会加上普通化疗方案,比如FOLFOX+爱必妥,FOLFIRI+爱必妥等),肝脏转移灶完全消失,这个病人现在生存了好几年,带瘤生存;
2.肠癌的靶向治疗,其实包括常规的化疗,和其他肿瘤(比如乳腺癌)相比,副作用没有那么明显,副作用主要是皮疹、手足综合征(手脚麻),出血(最严重),骨髓抑制(白细胞低),一般不会掉头发……
缺点:
1.适应症有限,仅针对转移患者;
2.用药过程一旦疾病进展,预后非常差;
3.费用昂贵,不单单靶向药物本身昂贵,而且刚开始还要做基金检测,也是几千的花费(当然现在靶向药物好多有慈善增药,有需要的患者可以去了解一下)
以上就是我了解的关于肠癌的靶向治疗方案的一些知识,有疑问的朋友可以给我留言提问。
上述观点只代表个人临床经验与看法,和本人所在单位无关,如确实有患者需要这方面的咨询,仍建议直接至医院门诊就诊询问,每个人情况不同,无法通过网络诊断及提供治疗方案,谢谢!
“如果你愿意一层一层一层的剥开我的心,你会发现,你会讶异,其实我没那么那么难治“
-------肿瘤君
1.什么是“靶向治疗“?
随着医疗科技的发展和对肿瘤研究的不断深入,医学家对肿瘤的认识逐渐从过去的实质病灶到细胞,进一步深化到分子水平。靶向治疗有一层特别”高大上“的外衣-----基于分子水平的疗法,它是特别针对那些与肿瘤生长、增殖、侵袭和转移等相关的基因和分子,而研发的药物,这些药物进入人体后,快速与目标基因和分子结合,从而抑制它们发挥致癌、促进瘤细胞生长和转移的能力,从而达到精准治疗、阻止肿瘤的发生和进展。
2.靶向治疗一定是最好的治疗方法吗?
我个人认为这个“最好”是有相对性的。靶向药必须作用于那些特定的与患者肿瘤生长增殖密切联系的基因。如果患者体内不存在这种特定的“坏基因”靶点,那么靶向治疗是没有意义的。
如果通过基因检测,找到了肿瘤相关基因的阳性表达,那么目前的确有一些相关靶向药物,可让更多患者的生存获益。因此,靶向治疗是近几十年来肿瘤治疗发展中一个重要的里程碑。比如在乳腺癌和胃癌中常用的靶向药------曲妥珠单抗(赫赛汀),就是通过与HER-2受体特异性结合而影响肿瘤生长相关信号的传递,同时抑制那些供给肿瘤细胞营养的血管生长,失去了丰富的血流供应,肿瘤细胞失去营养和能量无法生长。以往晚期癌症患者经过化疗后,中位生存期一般7-10个月,在靶向药物推出后,靶向+化疗使患者的生存时间比单纯化疗时间延长了半年以上,有的则可存活更久。这对于难治的晚期患者是非常宝贵的。
化疗药是细胞毒性药物,在杀死肿瘤细胞的同时,对人体正常的细胞,尤其是分裂增殖较快的细胞(如骨髓造血细胞、胃黏膜上皮细胞、血管上皮细胞等),会造成一定损伤。而靶向药是特定的消灭敌人~
所以概括起来,靶向药的优点就是:”特异、高效、低毒“。延长相关基因阳性患者的生存期,且不良反应发生率和严重程度都较传统化疗小。
3.靶向治疗的弊端
贵!!不赘述。
不良反应主要为心脏毒性、肝肾功能损伤,如阿帕替尼副作用为高血压、蛋白尿和手脚麻木、皮肤红斑肿胀等。有些则可引起肺部感染,必须及时送往医院。
那么,看了上述弊端,有人会问:都有听起来这么“吓人”的副作用了,还要不要用靶向药?是药三分毒,哪怕商店一盒口腔含片,都会给你写上几条副反应。因为临床试验,得出的阳性结论是看P值是否符合统计学意义,并不代表绝对的“0”和“1”。
是否选择靶向药,在完成基因检测获取“门票”后,是需要综合评估患者的身体状况,经济条件,患者的意愿后,才做的决定。至于“副作用”,是要看它们和“抗肿瘤”的优先级了。
最后,希望各位已经选择或者打算选择靶向治疗的患者,一定一定要观察用药后反应,及时复查,出现不适及时与医生沟通。
公众号:在这里,盐小姐提供一些医学科普、生命伦理的观点,也分享烟火人生。偶尔也会聊聊绘画、音乐、以及电影。愿你我都能更好的感受和热爱生命。


盐小姐送你们滴小心心~~哈哈哈

补充:很多人问我靶向药物到底能不能治好癌症,有关文献报道,对于一些早期癌症,通过基因筛查适合靶点,应用靶向药物有治愈的可能,注意是可能。
对于一些晚期的患者,应用靶向药物,疾病又进展了,那么维持靶向药物治疗,相比不使用,也可以部分延长生存期。
2019年的诺贝尔生理医学奖得主William G. Kaelin Jr教授曾于两年前在《自然》发表综述,指出当今癌症药物靶点研究的弊端,并提出相应的解决方案,其中的一些见解也适用于生命科学其他领域的研究。
撰文 ∣ William G. Kaelin Jr
编译 ∣ 李娟


识别药物靶点并检验其有效性是抗癌药物进入临床前研究的关键。目前,有关癌症靶点的最新研究层出不穷,但良莠不齐,存在不少问题,比如结论无法被重复验证、数据分析逻辑欠佳等。本文就癌症靶点验证研究中普遍存在的缺点及可能的解决方法做出阐明。
必要性与充分性
随着癌症研究数据的爆发出现,在挖掘有意义结论的过程中,区分相关性和因果关系是至关重要的。生物学中有许多例子:两个相互关联的事物并不存在因果关系,有时是因为二者都处于上游控制因素之下,有时二者只是偶然相关。
在描述因果关系时,有两个词特别有用:必要性和充分性。甲对乙是必要的,意味着如果甲不存在,乙就不可能是真的;甲对乙是充分的,意味着如果甲是真的,乙也会是真的——这对得出符合逻辑的结论是非常关键的。
例如,在恶性黑色素瘤中首次发现BRAF突变时,一些人认为BRAF突变不是好的药物靶点,因为其在良性痣中也存在。但这仅表明BRAF突变不足以引起恶性黑色素瘤,临床上我们更应看重的是BRAF的活性是否是BRAF突变黑色素瘤发展所必需的,这个问题现在已经得到肯定的回答。
此外,多重基因突变往往是癌症发生发展的必要条件,但并不说明必须联合使用靶向每个突变的药物才能充分治疗癌症。比如,尽管还存在其他诱发因素,但是在p53突变的肿瘤中恢复p53的功能就足以诱导癌细胞凋亡。联合用药的原因常是出于对耐药性的考量。因此,研究者一定要清晰地判断必要性和充分性,得出恰当的因果关系。
与不良预后相关的靶点判定
无法正确判断因果,就容易曲解癌症新药靶点的研究数据。例如,当发现某个靶点的表达与患者的不良结果相关,研究者表述结论时常暗示不良结果是该靶点引起的——这是不合理的。举个例子,就慢性肺病患者来说,需要呼吸机的病人相比不需要呼吸机的病人来说,病情往往更严重、表现更差,但解释数据时我们肯定不会认为这是呼吸机引起的。相反,需要呼吸机标示着病情发展到了更晚期的阶段。
在癌症生物学中,许多分子水平的变化与癌症侵袭性的增加有关,但这些分子不一定就是导致癌症侵袭性的原因。例如,缺氧诱导因子 (HIF) 的上调表达总是与患者的不良预后相关,这既可能意味着HIF导致某些肿瘤更具侵袭性,但也可能意味着,肿瘤生长缺乏血氧供应,才使得HIF上调。在后一种情况下,缺氧、缺氧诱导因子和不良预后之间存在因果关系,但因果关系方向与前一种推断正好相反。再如,雌激素受体(ER) 阳性的乳腺癌患者比ER阴性的患者的预后更好,并不是因为ER抑制癌细胞生长,而是ER驱动的乳腺癌比其他亚型更具惰性。事实上,ER是最有效的癌症治疗靶点之一。
总之,一个因素与不良预后相关,并不足以判断它是否能作为癌症治疗的靶点。即,与不良预后相关,并非选择靶点的必要且充分条件。
相关性+合理性≠因果关系
那么,两个事物之间的因果关联是如何确定的呢?通常是去干扰一个事物,同时测量另一个事物受到的影响。例如,当使用遗传或化学方法破坏蛋白A的功能,导致表型B丧失,说明蛋白A的活性对于B是必需的。当激活蛋白A,总是产生表型B,说明对于B来说,A是充分的。当然,这类实验并不能区分直接影响和间接影响,其机制将通过生化研究或结构研究得以补充。
然而,我们在文献中常见到基于生物学上的合理性对因果关系进行推断——“甲与乙相关,甲导致乙是合理的,因此甲导致乙。”例如,有论文做出结论说:“高水平HIF与癌症不良预后相关,很可能是高水平的HIF上调了那些促进血管生成的基因和肿瘤侵袭的基因,如血管内皮生长因子A (VEGFA) 和基质金属蛋白酶 (MMPs) 。”但是,这个论点忽略了HIF也上调抑制蛋白合成的基因和促进自噬的基因,而这类基因又是可以抑制肿瘤的。事实上,在某些模型中HIF促进肿瘤生长,在另一些模型中则抑制肿瘤生长。


类似地,癌症靶向药物发挥作用时,并不代表药物一定是通过抑制其预期靶点来杀死癌细胞的。例如,在临床前模型中,MELK(母体胚胎亮氨酸拉链激酶)的小分子抑制剂能较好地抑制肿瘤增殖,因此进入临床试验,制成抑制剂药物。然而Sheltzer等最近发现,当用CRISPR- Cas9去除细胞模型中的MELK,细胞仍然能够存活,而且还能对至少一种MELK抑制剂保持敏感,这显然表明该抑制剂药物并不是通过抑制MELK杀死细胞的。可见,基于相关性和合理性来推断因果是不恰当的。
上行表型分析更有说服力
在癌症生物学和癌症药理学进行表型分析时,必要性和充分性的概念也非常有用。
表型分析可以分为“上行分析” (up assays) 和“下行分析” (down assays) 两类。在上行分析中,人们找的是被测读数的增加,例如酶活性的增强或细胞适应性的增强,而在下行分析中,人们找的是被测读数的减少,例如被测蛋白水平的降低或细胞适应性的降低。
在提供生物学见解方面,上行分析通常优于下行分析,因为上行分析的信噪比更优,假阳性更少。对于给定的表型来说,必需的东西越多,该表型就越容易被损害。换句话说,降低系统性能的方法要比提高系统性能的方法更多。出于这些原因,进行高通量化学筛选和基因筛选的生物学家往往更喜欢上行分析。
然而,癌症科学家使用的表型分析几乎总是下行分析。例如,干扰癌细胞中特定蛋白质的功能,会降低细胞的生存力、增殖力、侵袭力或致瘤性(图1)。但我们同样需要知道,任何降低细胞内稳性或适应性的因素都可能催生上述下行结果。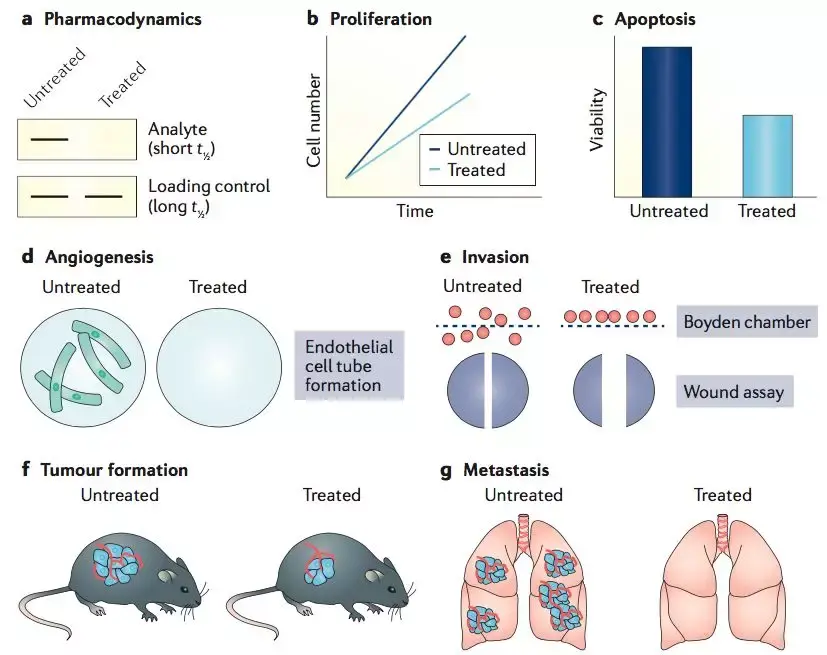
 图1 癌症生物学和癌症药理学中常用的下行表型分析。a, 基于分析物(蛋白质或磷酸表位)水平下降的药效学试验。注意如果分析物的半衰期短于正常对照(通常情况下),分析物水平的下降可能与特异性毒性药物无关,且会导致转录或翻译的整体下降。b, 细胞增殖实验。c, 细胞活性实验。d, 体外血管生成实验。e,
图1 癌症生物学和癌症药理学中常用的下行表型分析。a, 基于分析物(蛋白质或磷酸表位)水平下降的药效学试验。注意如果分析物的半衰期短于正常对照(通常情况下),分析物水平的下降可能与特异性毒性药物无关,且会导致转录或翻译的整体下降。b, 细胞增殖实验。c, 细胞活性实验。d, 体外血管生成实验。e,
那么,癌症生物学的研究可以实现上行分析吗?答案是肯定的。目前,很多癌症药效学实验是基于分析物(例如磷酸表位)的下调,那么,找到药物与靶点接触时快速诱导升高的分析物,就可以成为药效上行分析的依据。类似思路也适用于癌症生物学的化学和基因筛选实验。如果某个信号通路在正常细胞中致癌,但在报告细胞中抑癌或降低细胞适应性,那么就可以在报告细胞中通过上行分析来筛选抑制剂,而所用报告细胞可以是自然存在的也可以是经过分子工程改造的。
此外,癌症科学家通常使用化学物、siRNAs、shRNAs和sgRNA等来干扰癌细胞中特定靶点的功能,最终产生的表型既可能源自于干扰物对靶点的影响,也可能源自于对非靶点的影响,甚至对两者的共同影响。在细胞分析中,当发现某一干扰物导致下行表型时,应该同时考虑是否存在破坏细胞适应性的非靶点效应。干扰物可能达到了预期的药效学结论,并且产生了生物学合理的表型,但是这并不证明干扰物是通过结合靶点而导致该表型的——这是基于相关性和合理性推断因果关系的又一个反例。
癌症科学家需要明确一点:要证明因果关系,需要更多的步骤。
表型拯救实验
表型拯救实验是证明药靶因果关系的经典实验。例如,甲磺酸伊马替尼是ABL激酶活性抑制剂药物,它通过抑制致病性BCR-ABL融合蛋白来杀死慢性髓性白血病 (CML) 细胞,而该药物靶向作用的证实,则来自带有BCR-ABL突变体的CML细胞产生耐药性的证据。
制备耐药靶点突变体的方法有数种。例如,将表达靶点的哺乳动物cDNA载体导入特定大肠杆菌中用以积累错义突变,然后将随机突变的表达载体库导入对药物敏感的哺乳动物细胞系。加药后,筛选并扩增抗性细胞克隆,再对相应的表达载体进行测序,之后进一步测试鉴定出的突变体是否确实拮抗药物的生化作用,或者将突变体导入幼稚细胞之后观察能否产生抗药表型(图2a)。
Tarun Kapoor及同事开发了一种鉴定耐药突变体的方法,该方法不需要事先了解相关药物靶点。Deepak Nijhawan及同事进一步优化了该方法。在优化方法中,他们用药物去处理充满错义突变、存在天然错配修复缺陷的药物敏感细胞,筛出抗性细胞并克隆扩增,再进行RNA-seq和全外显子测序,以鉴定潜在的耐药基因并加以验证(图2b)。如果天然存在的MMR缺陷细胞系对所研究药物不敏感,或者其生物学特性不适合该方法,原则上可通过CRISPR-Cas9技术制备MMR缺陷细胞 (删除一个或多个MMR基因) 。类似的,Stephen Jackson及同事也报道了利用化学诱变单倍体哺乳动物细胞来鉴定耐药靶基因的方法。
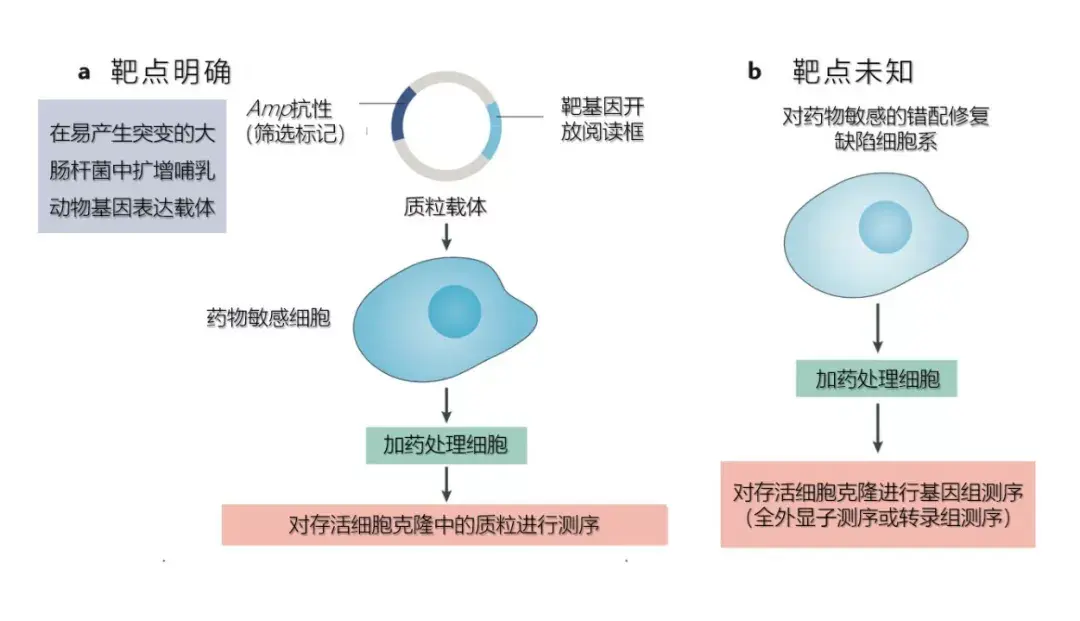
 图2 制备耐药突变体的方法(点击看大图)
图2 制备耐药突变体的方法(点击看大图)
在应用遗传干扰物如siRNA、shRNA和sgRNA的实验中,可同时导入表达靶点cDNA的载体来进行表型拯救。所用载体需不含干扰物结合位点,对干扰物不敏感。另一种逆转靶点表型的方法是恢复靶点下游的效应子功能。例如,激活BRAF下游的MEK1,可以使BRAF突变黑色素瘤细胞对BRAF抑制剂产生抗性。在这类表型拯救实验中,事先了解靶点下游效应子及其功能是非常重要的。
为了进一步明确功能丧失(或功能获得)是遗传干扰物作用于靶点所致,还可以测试相应的功能获得(或功能丧失)实验是否会导致相反的表型。例如,如果敲除靶点能够抑制肿瘤生长,那么过表达靶点则会促进肿瘤生长。但要注意一些靶点的表型效应可能与其表达水平或活性强弱没有线性关系。
如果上述表型拯救实验失败,很有可能说明药物存在非靶点效应。但是,我们需要知道,成功逆转某些表型可能还需要满足其他条件,比如导入的外源靶点必须达到内源靶点的丰度,并符合生理调控过程(例如细胞周期特异性调控)。解决这个问题(至少在蛋白质丰度方面)的一种方法是,将外源靶点基因置于可调控的启动子之下,然后使用CRISPR-Cas9删掉内源靶点表达。另一种方法是用含有靶基因顺式作用调节元件的细菌人工染色体(BACs)进行拯救实验。
在表型拯救实验中,为了明确表型与靶点的因果关系,排除非靶点效应,有必要使用多种试剂进行检测,比如用多个独立的shRNAs或用化学试剂对遗传试剂进行补充。使用不同种类的试剂得到互相佐证的实验结果,或者通过动物模型加强细胞模型的结果,会让癌症靶点验证研究更具说服力。
此外,更合理地设计阳性对照和阴性对照,对解释证明药靶的因果关系也非常重要。
肿瘤动物模型的使用
癌症靶点研究的一大挑战是确定临床可耐受的最终药物剂量,达到抑制肿瘤生长、理想情况下消退肿瘤的目的。为此,人们常用到肿瘤异种移植实验,而这类实验中常被忽视的一点就是用药的时机。
在肿瘤细胞移植之前、移植时或移植后立刻应用药物,都可能会高估药物靶点在肿瘤维持中的作用。例如,注射到免疫缺陷小鼠体内的106个肿瘤细胞必须经过至少10次倍增才能达到1cm3的荷瘤大小,如果用药时机过早,使细胞增殖变缓,那么同一时间段内细胞的9次倍增就能让荷瘤生长减少50%,而这一“好”结果其实是夸大的。
因此,理想情况下,应在已建好的荷瘤模型上使用药物,尤其是肿瘤转移模型。
另外需要注意的是,在免疫缺陷小鼠中引起肿瘤生长停滞的药物,在免疫正常小鼠中,可能会使肿瘤发生消退。
预测毒性
针对癌症靶点的新药物常常被批评或者否定,因为它可能具有潜在的毒性。比如,该靶点对维持正常胚胎发育或成年个体的生理功能很重要,而药物可能会导致胚胎不能正常发育,或破坏人体的生理功能……等。但这种论点有不妥之处,因为:
首先,新靶点在胚胎发育中的功能不一定代表成年个体中的情况,而且药物一般只是使靶蛋白功能失活,这与敲除该基因是不同的,因此将靶点的遗传功能用于判断化学药靶的毒性是会误导人的。其次,化学药物的剂量可以控制在一定范围,在达到治疗效果的同时避免产生毒性。最后,药物代谢存在物种差异,很多在动物模型中观察到毒性的药物,在人体内却观察不到。
结 语
未来抗癌药物的研发依赖于药物靶点的识别和验证,因此相关研究的可重复性和可靠性非常重要,应当鼓励研究者发布详细的实验细节、增进数据共享,这方面的原则和指南也已经出台(比如NIH Principles and Guidelines for Reporting Preclinical Research和The Reproducibility Project: Cancer Biology)。另外,学术期刊总是倾向于发表那些阳性结果或前后一致的论文,造成研究者有意无意地对研究结果进行挑选。然而,我们应该认识到,发表论文只是推进科研的手段,而不是目的。发表错误的或不可靠的论文既浪费了资源,也阻碍了科研进展。我们需要的是能够经得起时间检验的优秀研究。尽管高标准的设定意味着更多挑战,但只有这样,我们才能更有效地推进抗癌研究,惠及千秋。
本文编译自Kaelin, W. “Common pitfalls in preclinical cancer target validation”. Nat Rev Cancer 17, 441–450 (2017) doi:10.1038/nrc.2017.32
上一篇:赌王离世前,大房小女儿就状告亲姐?何家这部狗血豪门伦理剧难结局
下一篇:热点关注:民法典关于房、快递、婚姻及继承等生活50问
最近更新生活资讯
- 反转再反转,这部科幻末世灾难片真的爽
- 快捷指令sky电影捷径库
- 2021《自然》年度十大人物:塑造科学,造福社会
- 千里单骑救萝莉却被捕,“正义使者”成了谁的牺牲品?
- 浪漫爱情励志人生 最震撼人心的十部日剧(图)
- 短篇小说(家庭伦理)
- 推动农业绿色低碳循环发展 推动农业绿色发展、协调发展
- 资料:成奎安电影作品《灯草和尚》(1992)
- 稻盛和夫《活法》1
- 合肥市第六中学2019-2020学年下学期2019 级高一年级线上线下教学衔接学
- 全网的电视剧,电影和动漫无偿观看(每年的都有哦)
- 理想国
- 刺激!梅州首部限制级伦理微电影《幻镜》网络首映!
- 男人为何迷恋女人胸部?
- 陆小曼与林徽因:都是富养的女儿,差别在哪里?
- 问题已被解决?
- 看了多少烂片,才找出这92部经典!
- 金高银:怎么从拿8个电影奖的怪物新人沦为了被众嘲的“资源咖”?
- 猎天下第2部:河阴之变
- 封神演义读后感100字(五篇)
- 又一部岛国神作,堪称校园版《权力的游戏》!
- 【全面解读】2022年以后,再无“国产”BCBA?
- 鬼文化(商代的帝王文化))
- 豆瓣9.2分年度第一佳片,每一秒都是夏日初恋的味道
- 社会的重器:性侵犯罪信息统一查询平台,还校园一片蓝天
